Stamceller er utgangspunktet for alle kroppens celler og vev og er ansvarlige for vedlikehold og reparasjon av skade på vev i kroppen. Stamcellene har en unik evne til å fornye og mangfoldiggjøre seg gjennom celledeling over lang tid, og kan danne mer spesialiserte celler gjennom en prosess kalt celledifferensiering.
Fra en enkelt «urstamcelle», den befruktede eggcellen, utvikles et menneske med ulike celler med spesialiserte egenskaper. Etter befruktning deler den befruktede eggcellen seg i to, og disse første cellene er utgangspunktet til det som gjennom fosterutviklingen blir til de mange typene spesialiserte cellene i et menneske. Etter fødselen bidrar stamceller til å fornye vev og reparere skade i kroppen gjennom hele livet. Stamcellenes mange spesielle egenskaper gjør dem også til nyttige verktøy innen både forskning og medisin.
Stamceller i fosterutvikling og i kroppen vår
Stamceller kan deles inn i embryonale stamceller (ESC) og kroppsstamceller (somatiske stamceller) etter hvilket utviklingsstadie de finnes på, og hvilken funksjon de har.
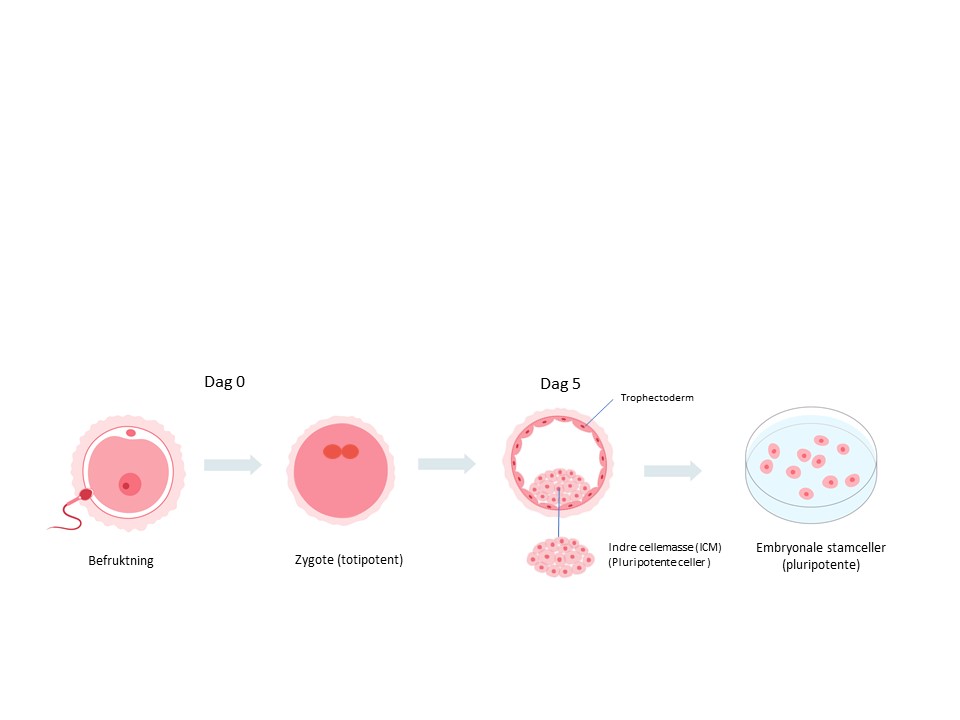
- Embryonale stamceller (ESC) i det tidlige embryoet er utgangspunktet for alle vev i det ferdige fosteret og for de over 220 ulike celletypene som finnes i et menneske. ESC kan hentes ut fra et tidlig embryo (blastocyst) noen dager etter at egget og sædcellen har smeltet sammen (figur 1).
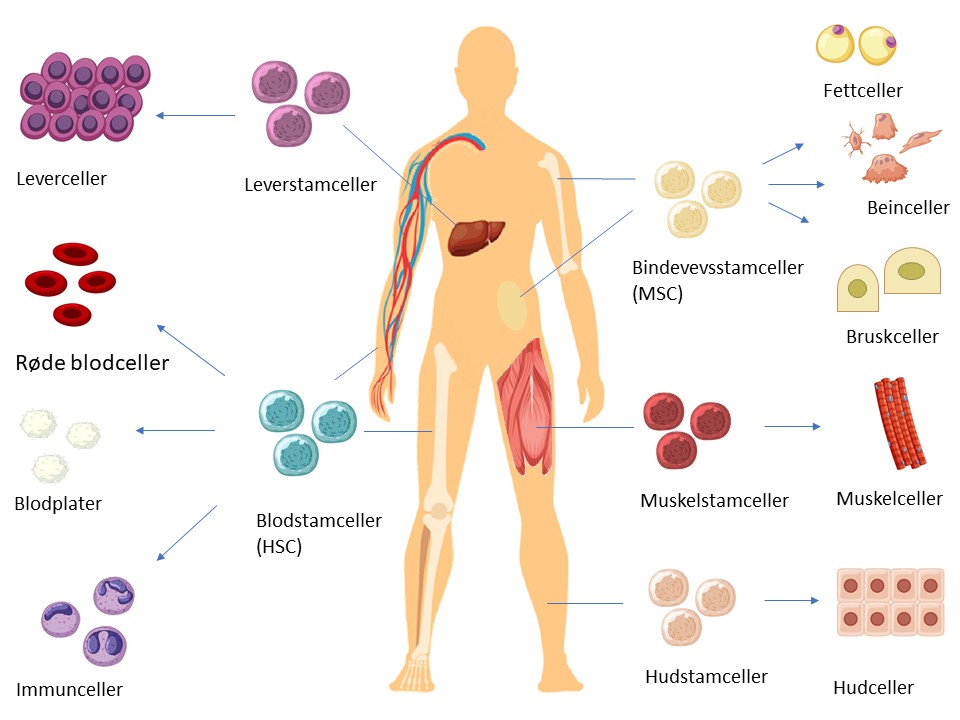
- Kroppsstamceller (også kalt somatiske stamceller) finner man i de fleste av kroppens ulike organer, i et lite antall. Disse cellene har til oppgave å fornye og vedlikeholde vevet og reparere skade. Kroppsstamceller kan ikke danne alle celletyper, kun de forskjellige celletypene knyttet til det vevet stamcellen har til oppgave å opprettholde.
Fosterstamceller regnes som kroppsstamceller og kan hentes fra morkake, fostervann eller et fosters navlestrengsblod, eller de kan hentes fra vev fra et abortert foster. Etter fødselen finnes kroppsstamceller i de fleste av kroppens organer og vev. Disse kaller vi adulte stamceller («voksne» stamceller). Hver dag dør tusenvis av celler i kroppen, enten som et resultat av skade, eller som en del av naturlige fornyings-prosesser. Døde og skadede celler blir erstattet fra små lagre med uspesialiserte stamceller i hvert vev (Fig. 2).
Ulike stamceller -ulikt utviklingspotensial
Stamceller kan også deles inn etter hvilket utviklingsspotensial de har, altså hvor mange ulike typer celler de kan gi opphav til.
- Totipotente stamceller: Er stamcellene med det største utviklingspotensialet. Disse cellene kan gi opphav til alle celletyper i mennesker samt morkake og ulike fosterhinner. Den befruktede eggcellen er totipotent.
- Pluripotente stamceller: Kan gi opphav til alle celletyper i mennesker, men ikke morkake og fosterhinner. Det finnes to kilder til pluripotente stamceller hos mennesker: Embryonale stamceller (ESC), som kan hentes ut fra et tidlig embryo, og induserte pluripotente stamceller (iPSC) som kan lages fra differensierte kroppsceller i laboratoriet. (Les mer om iPSC lenger under.)
- Multipotente stamceller: Kan bli til en rekke ulike celletyper. Et eksempel er blodstamceller (Hematopoetiske stamceller – HSC) som kan høstes fra beinmarg eller blod og som kan utvikle seg til en rekke ulike immunceller og blodcelletyper. Bindevevsstamceller (Mesenchymale stamceller -MSC) fra beinmarg eller fettvev som kan danne bein, brusk, og fettvev er et annet eksempel på multipotente stamceller.
- Unipotente stamceller: Unipotente stamceller finner vi i kroppens ulike vev der de kan gi opphav til celletypen knyttet til akkurat det vevet. Muskelstamceller som kun kan gi opphav til muskelceller, er et eksempel på unipotente stamceller.
iPSC – pluripotente stamceller fra kroppsceller
Pluripotente stamceller har et stort potensial innen regenerativ medisin og er viktige innen forskning blant annet fordi de kan hjelpe oss å forstå hvordan kroppens ulike celler og vev dannes. Frem til nylig var den indre cellemassen i en blastocyst den eneste kilden til pluripotente stamceller hos mennesker. Men når man tar ut embryonale stamceller ødelegges også embryoet. For å unngå å ødelegge embryo forsøkte forskere å finne alternative måter å lage pluripotente stamceller på. I 2006 ble en hel forskningsverden overrasket over hvor enkelt dette var da forskerne Shinya Yamanaka og Kazutoshi Takahashi viste at kroppsceller kan «reprogrammeres» tilbake til pluripotente stamceller. Ved å sette inn kun fire gener (Oct3/4, Sox2, Klf4, c-Myc) i cellene til mus klarte de to forskerne å omdanne vanlige kroppsceller til pluripotente stamceller i laboratoriet. Forskerne hadde vist tidligere at disse fire genene (nå kalt Yamanaka-faktorene) er helt sentrale i embryonale stamceller.
I 2007 laget de samme forskerne pluripotente stamceller fra mennesker. De hentet en bit med hud fra ansiktet til en 36 år gammel kvinne og lot hudcellene gro i en skål. Ved hjelp av virus satte de inn de fire Yamanaka-faktorene i cellene og lot cellene vokse videre. I løpet av tre uker ble hudcellene omprogrammert til uspesialiserte stamceller, med de samme egenskapene som embryonale stamceller. I prosessen hadde transkripsjonsfaktorene (proteinene de fire genene kodet for) fått DNA-et til å skru på en rekke andre gener som er aktive i stamceller.
Stamceller som lages på denne måten, kalles induserte pluripotente stamceller (forkortes ofte til iPSC). Shinya Yamanaka, som ledet den japanske forskningsgruppen, fikk Nobelprisen i medisin i 2012 for oppdagelsen. Aldri tidligere i Nobelprisens historie har det gått så kort tid mellom at en oppdagelse ble gjort på laboratoriet til utdeling av prisen.
I 2009 ble Tiny født, den første museungen som er laget av en hudcelle. Forskerene satte iPSC laget fra en hudcelle inn i et spesielt embryo, en tetraploid blastocyst. Denne blastocysten inneholder det som skal til for å lage morkake og andre vev nødvendig for fosterutviklingen, men ikke for å danne selve fosteret. Fosteret måtte dermed dannes fra de omprogrammerte hudcellene. Embryoet fikk utvikle seg i en surrogatmor og resultatet var altså en komplett og levende museunge. Tinys fødsel viste med sikkerhet at Yamanakas omprogrammerte hudceller har evne til å utvikle seg videre til alle typer celler og at de har det samme utviklingspotensialet som embryonale stamceller.
Stamcelledeling og differensiering
Stamceller har altså potensialet til å dele seg og ved deling la den «nye cellen» utvikle seg til en spesialisert celle. Denne overgangen fra stamcelle til spesialisert celler (celledifferensiering) er ledsaget av endringer i cellens funksjon og utseende. Men hvordan foregår denne prosessen?
Alle celler i kroppen inneholder de samme genene, men ulike gener er skrudd på i ulike celler og til ulik tid. Når en stamcelle deler seg, kan det bli dannet to nye, like stamceller. Det kan også bli dannet én ny stamcelle og én mer spesialisert celle som deretter deler seg videre om og om igjen slik at det kan bli dannet tusenvis av spesialiserte celler fra én og samme stamcelle (Figur 3). Dette kalles asymmetrisk celledeling. I denne typen celledeling får hver av de to dattercellene ulike egenskaper. Den ene cellen forblir en uspesialisert stamcelle, og beholder evnen til ubegrenset celledeling (selvfornying), mens den andre dattercellen utvikler seg til en spesialisert celle som skal gjøre en jobb i det aktuelle vevet. I cellen som spesialiseres blir celletypiske gener slått på og gener assosiert med selvfornyelse dempet. Disse cellene mister noen av stamcellens egenskaper på veien og har ikke «evig liv» slik som stamcellene. Epigenetiske mekanismer og transkripsjonsfaktorer (proteiner som regulerer hvilke gener som skal være «på» i en celle på et gitt tidspunkt) er viktige for å bestemme hvilken utviklingsvei stamceller skal ta (Les mer om epigenetiske mekanismer på temasiden om epigenetikk).
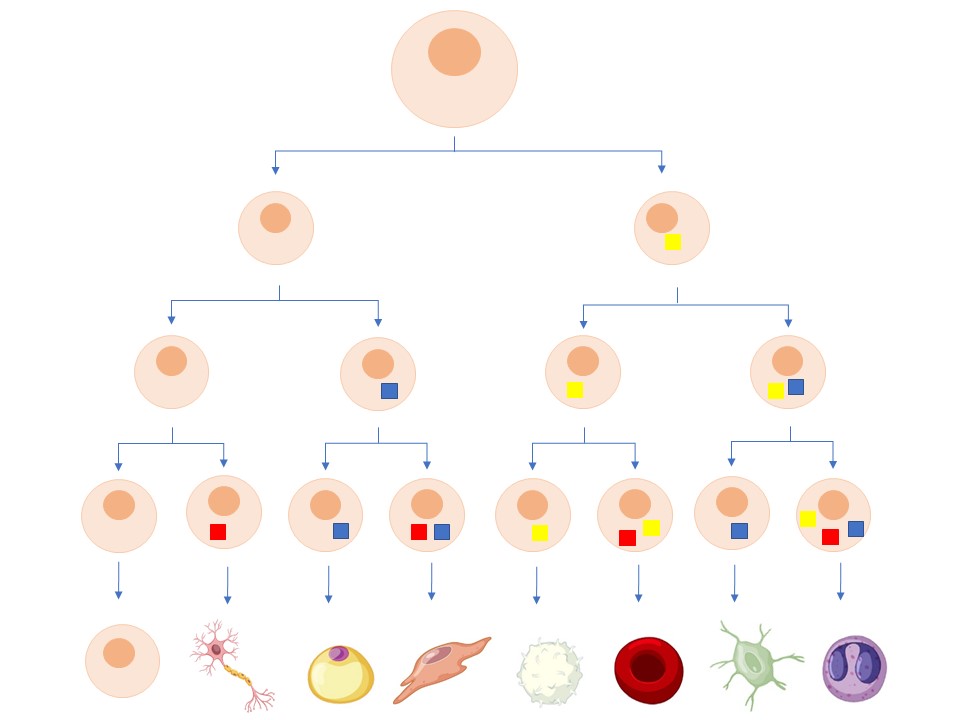
Stamceller i medisin
Innen medisin kan man bruke stamcellers unike evne til å fornye seg og til å danne spesialiserte celletyper til å stimulere kroppens reparasjonsmekanismer, og til å gjenopprette funksjon i syke eller skadede vev eller organer.
Blodstamceller i beinmarg var blant de første stamcellene som ble identifisert hos mennesker, og blodstamceller var de første stamcellene som ble tatt i bruk i medisinsk behandling for over 50 år siden. Blodstamceller er opphav til en rekke ulike blodceller og immunceller, men både sykdom og aggressiv kreftbehandling ved cellegift og stråling kan skade blodstamcellene. Da kan beinmargstransplantasjon være nødvendig. Transplanterte beinmargsstamceller, enten fra pasienten selv eller fra en donor, kan hjelpe kroppen å få i gang produksjonen av nye blodceller som kan erstatte syke eller ødelagte celler.
I Norge har beinmargstransplantasjon vært en del av etablert kreftbehandling i mange tiår, men det forskes også på om den samme metoden kan brukes til å «restarte» eller bygge opp et nytt immunsystem hos pasienter som lider av autoimmune sykdommer som MS. Andre forskningsgrupper undersøker om stamceller kan brukes til å bygge nytt bein etter sykdom eller skade der pasienten har mistet så mye bein at kroppen ikke klarer å reparere skaden selv. En lovende strategi er å bruke bindevevsstamceller, såkalte mesenchymale stamceller (MSC), fra pasienten selv, til å bygge nytt beinvev. I denne utgaven av Biotekpodden kan du høre hvordan forskere i Bergen gir smilet tilbake til pasienter med periodontitt, en sykdom som kan føre til at benvev i kjeven brytes ned og tennene løsner. Bruk av kroppsstamceller er ikke omstridt slik embryonale stamceller er. Det er fordi disse stamcellene som oftest hentet fra voksne individer, og gjerne fra pasienten selv.
Foreldre som har et barn med en alvorlig sykdom som trenger en stamcelledonor, kan i noen tilfeller få tilbud om PGD/PGT (gentesting av befruktede egg) for å få et nytt barn med riktig vevstype som kan fungere som donor. Da vil man høste stamceller fra navlestrengen til barnet når det fødes og disse cellene kan brukes i behandling av det syke søskenet. Les mer på temasiden om gentesting av befruktede egg (PGD/PGT).
Noen foreldre lurer på om de bør lagre navlestrengsblod fra den nyfødte som en «forsikring» mot fremtidig alvorlig sykdom. Nytten av tapping og lagring av navlestrengsblod til eget bruk er ikke vitenskapelig dokumentert, og det finnes ingen behandlinger i det offentlige norske helsevesenet som baserer seg på bruk av eget navlestrengsblod. Dette kan du lese mer om på helsenorge.
Pluripotente stamceller i regenerativ medisin
Det er i all hovedsak adulte multipotente kroppsstamceller som så langt er tatt i bruk i medisinsk behandling, men anvendelsen er begrenset av at slike stamceller kun kan lage et begrenset antall typer celler. Mange forskere håper at pluripotente stamceller kan løse dette problemet og bli viktige i fremtidens celle- og vevserstatningsterapier. Pluripotente stamceller kan ikke bare danne alle kroppens celletyper, men har også evnen til å dele seg og danne nye celler over lang tid slik at de kan fungere som en nærmest ubegrenset kilde til celler som i teorien kan erstatte en hvilken som helst skadet celletype/vev.
Forskere håper at pluripotente stamceller kan brukes til å erstatte skadet hjertevev etter et hjerteinfarkt, til å behandle ulike former for synstap, eller til å erstatte nerveceller som er ødelagt etter skade eller sykdommer som Parkinson, Alzheimers, Amyotrofisk lateral sklerose (ALS), eller multiple sklerose (MS). Men en viktig forutsetning for å kunne ta i bruk pluripotente stamceller i behandling av sykdom er at man kan klarer å kontrollere stamcellene i kroppen. Pluripotente stamceller har sin store evne til celledeling felles med kreftceller, og en bekymring knyttet til bruk av pluripotente stamceller er om de kan danne svulster i kroppen. Et annet spørsmål er hvordan man kan sikre at de utvikler seg til akkurat den celletypen det er behov for hos pasienten.
Det foregår en rekke kliniske forsøk med terapier basert på enten ESC (embryonale stamceller) og iPSC (induserte pluripotente stamceller). Slike stamceller er blant annet testet i behandling av ryggmargsskade, synstap, ved diabetes og etter hjertesykdom der hjertet har fått for lite oksygentilførsel. Selv om mange av de pågående kliniske studiene har tatt utgangspunkt i ESC, som har vært tilgjengelig nesten 10 år lenger enn iPSC, ser man de siste årene en tydelig trend til at flere av de utprøvende behandlingene bruker iPSC. Dette skyldes nok dels de etiske bekymringer knyttet til at embryo må ødelegges for å få tilgang til embryonale stamceller, men iPSC har også et stort fortrinn ved at man kan lage dem fra pasientens egne celler (Figur 4). Stamceller laget på denne måten vil ha den samme genetiske bakgrunnen som pasienten selv, og slik sikrer man at de transplanterte cellene ikke avvises av kroppen.
Men også iPSC fra donorer kan bli viktige i fremtiden. Shinya Yamanaka har startet et stort prosjekt i Japan hvor han og kollegaene bygger opp en stor iPS-stamcellebank med celler fra noen få donorer, ikke ulikt slik en blodbank fungerer. Donorene er i dette tilfellet valgt fordi de har celler som immunforsvaret reagerer svakt mot. Målet er at iPS-cellene i cellebanken kan brukes som utgangspunkt for å utvikle ulike typer vev, blod og celler som kan settes inn i andre pasienter.
Det forventes at bruk av iPSC vil åpne for at stamcellebehandling i fremtiden kan bli aktuelt ved mange ulike tilstander (les mer om cellebaserte genterapier her). Sammen med genredigeringsteknologi (les mer om genredigering og Crispr her) er det mulig å endre stamcellenes genetiske innhold og lage stamceller med økt funksjonalitet og nye egenskaper.
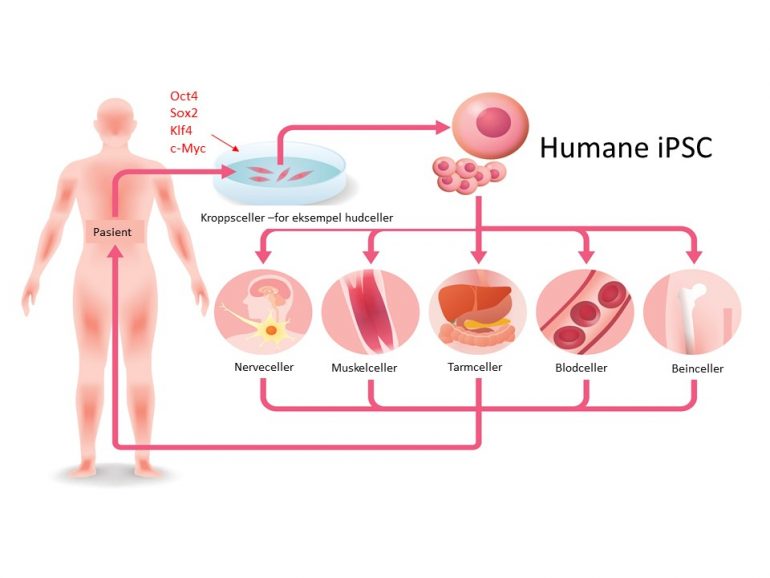
Stamceller og vevsteknologi
Stamcelleterapi kan altså brukes til å hjelpe kroppen å lege seg selv, men forskere forsøker også på ulike måter å bruke stamceller som utgangspunkt for å lage nytt vev og nye organer helt fra bunnen av. Vevsteknologi (tissue-engineering) er teknologi som bruker celler og ulike materialer til å bygge nytt vev for å erstatte skadet vev eller hele organer. Stamceller fungerer som «byggestenene» i byggverket, og tilføres de biologiske molekylene cellene trenger for å vokse og utvikle seg riktig. Ofte kombineres cellene med ulike materialer, som proteiner eller plast, som fungerer som «stillaser» som nytt vev kan bygges rundt.
En annen strategi det forskes mye på er å lage nye tredimensjonale organer lag for lag ved såkalt 3D-printing der stamceller erstatter blekk i printeren.
Forskere jobber i dag med å bruke vevsteknologi for å lage blant annet hud, hjertevev, blodårer, brusk og bein. I 2016 godkjente amerikanske godkjenningsmyndigheter en vevsterapi som består av pasientens egne celler og en bionedbrytbar biologisk membran som opereres inn i pasientens for å reparere bruskskade i kneet. Men for mange andre cellebaserte vevsterapier er veien lang fra forskning og frem til man kan lage hele fungerende organer på denne måten.
Stamceller i forskning
Stamceller har også mange viktige bruksområder innen biologisk og biomedisinsk forskning. Humane stamceller, inkludert embryonale stamceller, fosterstamceller og voksne stamceller fra ulike vev, kan dyrkes i laboratoriet. Dette gir forskerne muligheten både til å studere grunnleggende biologiske mekanismer, utviklingsprosesser og hvordan celler og organer fungerer både normalt og ved sykdom. Stamcellekultur, der cellene dyrkes flytende i næringsløsning eller i et enkelt lag på en overflate, brukes også til å teste hvordan humane celler reagerer på forskjellige nye medisiner.
Organoider- «miniorganer» fra stamceller
Forskere bruker også stamceller til å lage mer avanserte modeller av menneskelige organer og vev. Ved å etterligne de prosessene som foregår når organer dannes under embryoutviklingen, kan forskerne gi uspesialiserte stamceller de kjemiske signalene og betingelsene som er nødvendig for dannelsen av et bestemt vev eller organ i laben. Slik kan stamceller brukes til å lage organoider: Tredimensjonale cellulære strukturer som ligner på deler av organet de er ment å modellere.
Forskere har laget organoider med cellestrukturer og funksjoner som ligner på flere av kroppens organer. Organoider laget av menneskeceller er lettere å eksperimentere på enn vev og organer som er i kroppen, og siden de er tredimensjonale etterligner de ulike celletyper, strukturer og organfunksjon bedre enn tradisjonell cellekultur. Dette har gjort organoider til viktige forskningsmodeller som tas i bruk til å løse stadig nye forskningsspørsmål innen biologisk og biomedisinsk forskning og farmasi.

Kimærforskning
Et alternativ til å lage stamcellebaserte menneskelige organer i laboratoriet er å lage menneskelige organer i dyr. Såkalte kimære organismer er organismer som inneholder celler fra flere genetisk forskjellige individer. Kimære organismer blir til ved å sette inn pluripotente stamceller (enten ESC eller iPSC) inn i en blastocyst fra et annet individ og så la blastocysten utvikle seg videre i en surrogatmor. Man kan bruke celler fra samme art, men det er også mulig å kombinere celler fra ulike arter på denne måten. Forskere har blant annet lykkes med å lage kimære organismer ved å kombinere to ulike musearter og to ulike kvegarter.
Studier fra andre arter viser at det er utfordrende å lage kimærer fra arter som ikke er nært beslektet. I 2021 fikk en internasjonal gruppe forskere mye oppmerksomhet da de rapporterte at de hadde laget kimære befruktede egg med celler fra både aper og menneske (les mer i denne GENialt saken). Disse kimære befruktede eggene var aldri ment å få utvikle seg til levende dyr. Forskerne ønsket å bruke dem for å studere grunnleggende biologiske mekanismer. Men de bryter likevel både artsbarrieren og utfordrer etiske grenser.
Kimære, humaniserte dyr kan tenkes å være nyttige som dyremodeller for menneskelig sykdom, mens dyr med menneskelige organer kunne fungere som vevs- eller organdonorer for mennesker. Om dette i fremtiden vil være teknisk mulig, og etisk akseptabelt gjenstår å se.
Stamceller, syntetiske kjønnsceller og embryo
Pluripotente stamceller kan utvikle seg til kroppsceller, men også til kjønnsceller om de gis de riktige betingelsene i laboratoriet. De siste ti årene har forskere kommet langt i å lage både kjønnsceller og embryomodeller fra pluripotente stamceller. I mus har man vist at både embryonale stamceller og iPSC kan brukes til å lage celler som ligner både egg og sædceller, og som kan gi opphav til normale museunger etter befruktning. Denne forskningen er i første omgang viktig for å forstå hvordan kjønnsceller dannes og hva som svikter hos mennesker som ikke produserer fungerende kjønnsceller. Men muligheten til å lage kjønnsceller fra for eksempel hudceller åpner også for nye muligheter.
Dersom teknologien kan overføres fra mus til andre arter kan det i fremtiden kanskje bli mulig å lage kjønnsceller fra hudcellene til en person for å behandle infertilitet. Vi kan også tenke oss at den samme teknologien kan brukes til å «gjenopplive» utdødde eller truede dyrearter.
Biologer bruker også pluripotente stamceller til å lage strukturer som ligner tidlige embryo (les mer om slike tidlige embryomodeller i denne GENialt-saken). Slike embryomodeller kalles også embryoider og brukes blant annet til å forske på de tidligste stadiene av menneskets utvikling, for å forstå hvorfor noen kvinner har problemer med å bli gravide, og hvorfor en høy andel av graviditeter resulterer i tidlig aborter, allerede før kvinnen vet at hun er gravid.
Etikk
Stamcelleforskning og stamcelleterapier reiser flere etiske problemstillinger. Embryonale stamceller har et unikt utviklingspotensial og har derfor mange mulige bruksområder innen både forskning og medisinsk behandling. Men tilgangen til befruktede eggceller er begrenset, og det er for mange etisk problematisk å bruke embryonale stamceller i forskning og medisin fordi et menneskeembryo må ødelegges for å få tilgang til de embryonale stamcellene. Begge deler er faktorer som kan ha begrenset utviklingen av kliniske terapier basert på humane embryonale stamceller. Oppdagelsen av induserte pluripotente stamceller (iPSC) løser flere av utfordringene knyttet til embryonale stamceller (ESC) både innen forskning og medisinsk behandling. Men flere utfordringer gjenstår.
I motsetning til for ESC handler de etiske utfordringene knyttet til bruk av iPSC mer om hva cellene brukes til enn hvor de kommer fra. Både organoideforskning, kimærforskning og forskning på syntetiske kjønnsceller og embryolignende strukturer er omdiskutert.
Innen organoideforskning er noen typer organoider mer kontroversielle enn andre. Det er for eksempel knyttet særlige etiske utfordringer til bruken av hjerneorganoider. Kan disse «minihjernene» en dag bli så avanserte at de kan få bevissthet? Kan de lide? Og bør man ha egne retningslinjer for denne typen forskning slik man har egne retningslinjer for bruken av forsøksdyr? Du kan høre mer om dette i Biotekpodden,
Kimærforskningen reiser problemstillinger knyttet til dyrevelferd, og til det å krysse artsbarrierer. Særlig problematisk er kimæreforskning om man lager kimærer mellom dyr og mennesker der humane celler ender opp i hjernen eller i kjønnsceller. Risikerer man å lage dyr som tenker som mennesker, eller et dyr som kan lage menneskelig avkom?
Noen av disse problemstillingene ligner på hverandre og gjelder mange typer modeller som brukes for å studere biologiske fenomener hos mennesker: Vi bruker modellene for å erstatte eksperimenter som ikke lar seg gjennomføre av etiske hensyn eller fordi det er for risikabelt. Samtidig er det viktig at modellene er representative, at de ligner på det vi egentlig ønsker å studere. Men jo bedre modellen blir, jo mer den ligner på det den etterligner, og jo større er sjansen for at vi vil møte på de samme etiske utfordringene vi nettopp prøvde å unngå ved å bruke en forskningsmodell.
En grunn til å forske på blastoider, embryomodeller laget med iPSC, er at man unngår noen av de etiske utfordringene knyttet til å forske på embryo blitt til ved befruktning. Det befruktede egget, om det får utvikle seg, er utgangspunktet for et menneske. Av denne grunn kan forskning på befruktede egg for mange være etisk utfordrende, og embryoforskning også strengt regulert i mange land. I Norge er det ikke tillatt å befrukte et egg kun for forskningsformål, men det er lov å forske på overtallige befruktede egg inntil 14 dager etter befruktning. 14-dagersgrensen gjelder trolig ikke kunstige embryomodeller, slik lovteksten er skrevet i dag. Selv om blastoidene ligner humane embryo, kan blastoidene vi har i dag ikke kunne utvikle seg til et komplett menneske. Ved å forske på blastoider i stedet for tidlige embryo som er blitt til ved befruktning, kan forskere derfor omgå både 14-dagersgrensen for embryoforskning og noen av de etiske utfordringene knyttet til forskning på tidlige stadier av menneskelivet. Samtidig jobbes det stadig med å utvikle modellene for å bli enda likere embryo. Når blir modellen så lik en ekte blastocyst at de må ha den samme moralske statusen? Hvor like kan embryomodeller bli før de bør ha de samme rettighetene som embryo som er blitt til ved sammensmeltning av en sædcelle og en eggcelle? Lignende problem gjelder organoideforskning. Hvor avansert funksjoner kan en hjerneorganoide utvikle før det er problematisk å forske på den?
Bruk av stamceller i medisinsk behandling handler om andre typer problemstillinger: i hovedsak om risiko, om ærlig kommunikasjon av dokumentert effekt av nye innovative behandlinger og om lik tilgang på helsetjenester. Stamcellebehandlinger for en rekke tilstander er enda under utvikling eller på utprøvingsstadiet. Krav til dokumentasjon av nye behandlinger og rutiner for markedsføringsgodkjenning og offentlig finansiering av nye behandlinger kan variere fra land til land. Dermed kan behandlinger som ikke er godkjent for en pasientgruppe i Norge være tilgjengelig i andre land. Det finnes også en mengde av private klinikker i ulike land som tilbyr stamcellebehandlinger med varierende dokumentert effekt. Pasienter som har råd til å betale for det kan velge å reise utenlands for å få slike, ofte svært dyre, behandlinger. Dette kan både føre til ulikheter i helsetilbud, og at pasienter selv betaler enorme summer for behandling som har liten nytte eller som i verste fall er direkte skadelig for pasienten.
Spørsmål til diskusjon:
- Er det etisk akseptabelt å befrukte egg dersom det eneste formålet med befruktningen er å utvinne stamceller som kan brukes til forskning eller behandling.
- Er det etisk forskjell innen kimærforskning på å sette menneskeceller i dyre-embryo og å sette dyreceller i menneske-embryo?
- Hva er forskjellen i den etiske vurderingen ved å lage hjerneorganoider sammenliknet med andre organer?
- Hva må til for at en syntetisk embryomodell skal ha de samme rettighetene som et embryo som er blitt til ved befruktning?
- Bør samfunnet tillate at hudceller kan brukes til å lage egg og sædceller hvis det viser seg at metoden er trygg?
Innholdet på denne siden ble sist oppdatert i september 2023. Send oss en e-post om du har kommentarer eller spørsmål til innholdet.
Referanser:
- Niakan KK, Han J, Pedersen RA, Simon C, Pera RA. Human pre-implantation embryo development. Development. 2012;139(5):829-841. doi:10.1242/dev.060426
- Wu, H., Sun, Y. Epigenetic Regulation of Stem Cell Differentiation. Pediatr Res 59, 21–25 (2006). https://doi.org/10.1203/01.pdr.0000203565.76028.2a
- Essentials of Cell Biology, Unit 5.4 Cell Biology for Seminars, Unit 5.4 https://www.nature.com/scitable/topicpage/cell-differentiation-and-tissue-14046412/
- Aly RM. Current state of stem cell-based therapies: an overview. Stem Cell Investig. 2020;7:8. Published 2020 May 15. doi:10.21037/sci-2020-001
- Yeo, R. W. Y. , & Lim, S. K. (2011). Embryonic Stem Cells for Therapies – Challenges and Possibilities. In (Ed.), Embryonic Stem Cells – Basic Biology to Bioengineering. IntechOpen. https://doi.org/10.5772/23762
- Edward H. Ntege, Hiroshi Sunami, Yusuke Shimizu. Advances in regenerative therapy: A review of the literature and future directions, Regenerative Therapy. Volume 14,2020,Pages 136-153, ISSN 2352-3204, https://doi.org/10.1016/j.reth.2020.01.004.
- Zhang, Pu-Yao et al. “Generation of Artificial Gamete and Embryo From Stem Cells in Reproductive Medicine.” Frontiers in bioengineering and biotechnology vol. 8 781. 22 Jul. 2020, doi:10.3389/fbioe.2020.00781
- Gabriel, E., et al., Human brain organoids assemble functionally integrated bilateral optic vesicles. Cell Stem Cell, 2021. 28(10): p. 1740-1757.e8.