Genredigering er en ny teknologi som gjør det mulig å gjøre målrettede endringer i DNA-et til alle levende organismer. Den meste brukte metoden for genredigering er Crispr, hvor man bruker proteinet Cas9 til å klippe i genomet samt en kort RNA-sekvens til å styre hvor endringen skal skje.
Nye metoder for å endre i gener fører med seg mange muligheter og krevende etiske spørsmål, og et så kraftfullt verktøy som genredigering skaper debatt innen viktige felt som medisin og matproduksjon.
Tradisjonelle metoder for genmodifisering er basert på å sette hele gener tilfeldig plassert inn i arvestoffet til en organisme. For genmodifisering av planter og dyr har dette ofte vært gener fra andre organismer (transgen) slik at de genmodifiserte organismene (GMO) får helt nye egenskaper.
Med genredigering er det mulig å gjøre endringer i genene som allerede finnes i mennesker eller andre organismer. Man kan for eksempel gjøre endringer i en genvariant som forårsaker sykdom (se temaside om genterapi), eller skru av gener som gjør dyr eller planter sårbare for sykdom, såkalte sårbarhetsgener (se temaside om genteknologi i planter og dyr).
Det finnes ulike metoder for genredigering. Alle baserer seg på proteiner som kutter DNA på helt spesifikke steder, som en slags målstyrt «gensaks». Zinkfinger- og TALEN-teknologiene var de første som ble utviklet, men de er kostbare og tidkrevende å bruke. I 2012 presenterte forskerne Emmanuelle Charpentier og Jennifer A. Doudna en ny metode, kalt Crispr, som er enklere og rimeligere i bruk enn andre metoder for genredigering. Charpentier og Doudna fikk Nobelprisen i kjemi for dette arbeidet i 2020.
Crispr er en forkortelse for Clustered Regularly Interspaced Short Palendromic Repeats, og beskriver et system bakterier bruker som et slags immunforsvar mot virus.
Hva er Crispr?
Det unike med Crispr er at det er svært enkelt å programmere gensaksen til å klippe der en ønsker i genomet. Crispr virker i alle typer celler og organismer, og man kan i prinsippet endre de genene man måtte ønske ved alt fra å gjøre mindre endringer i en gensekvens til å fjerne eller legge til DNA. Man kan også bruke Crispr til å sette inn gener for nye egenskaper (transgen) slik man gjør ved klassisk genmodifisering, men ved å bruke Crispr kan man styre hvor i genomet genet settes inn.
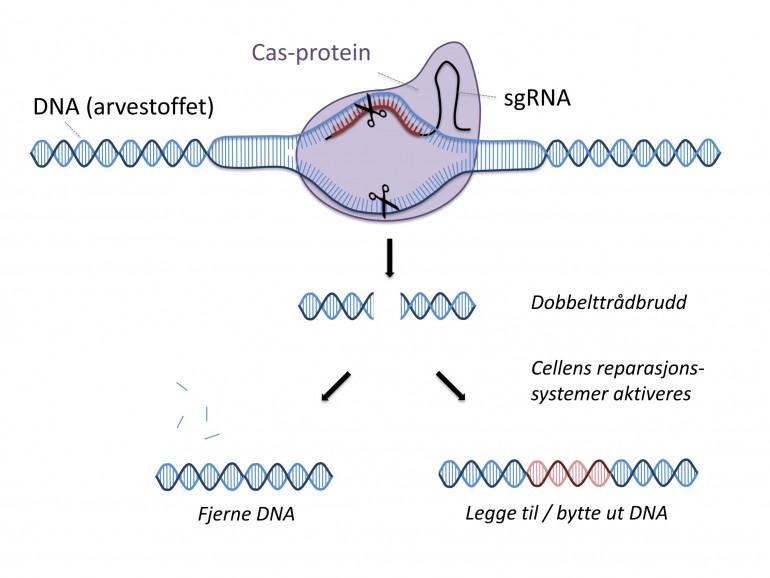
Crispr baserer seg på bakteriers immunforsvar mot bakterievirus (såkalte bakteriofager). Når en bakterie blir infisert av virus, kutter proteinet Cas9 ut en bit av virusets DNA og lagrer dette i sitt eget genom. Det fungerer da som et slags immunologisk minne om virusinfeksjonen. Neste gang det samme viruset infiserer bakterien, oversettes bakteriens lagrede DNA-minne til et RNA-molekyl. Dette RNA-molekylet styrer Cas9-proteinet for å finne frem til en tilsvarende sekvens i virusets DNA. Cas9-proteinet klipper da i denne delen av virusets DNA og ødelegger det, slik at infeksjonen stoppes.
Doudna og Charpentier viste at man ved å lage guide-RNA-molekyler med ulike sekvenser kan bruke Crispr-systemet til å «finne» og kutte i en enhver ønsket DNA-sekvens i en celle. Dermed kan Crispr brukes som en programmerbar gensaks for å gjøre genetiske endringer akkurat i den sekvensen i genomet hvor man ønsker en endring.
Et dobbelttrådkutt i DNA vil føre til at cellen iverksetter reparasjonsmekanismer for å reparere DNA-et. Én form for reparasjon går på å lime sammen DNA-endestykkene (ikke-homolog endebinding). Ved denne prosessen vil noe av DNA-et bli fjernet eller lagt til, som kan føre til at et gen blir satt ut av funksjon (knock-out).
Man kan også bruke Crispr til å sette inn en ny gensekvens eller endre på en gensekvens. Da gjør man et dobbeltrådkutt i DNA samtidig som man tilfører cellen en DNA-tråd med ønsket sekvens. Cellen vil da bruke DNA-tråden som mal når kuttet repareres. Ved denne prosessen utnytter man en annen av cellens reparasjonsmekanismer, homolog rekombinasjon.
Crispr-metoden har raskt blitt tatt i bruk i biologisk og biomedisinsk forskning. Dette har gitt nye muligheter for å forstå hvordan gener fungerer i mennesker og andre arter, både normalt og ved sykdom. Teknologien forventes også å få stor betydning for blant annet industriell bioteknologi og syntetisk biologi, for medisinsk behandling av mennesker, og for utvikling av planter og dyr med forbedrede egenskaper innen landbruk og næringsmiddelindustrien.
Siden Crispr-metoden ble oppdaget har forskere jobbet med å forbedre metoden. Blant annet har nye versjoner av Crispr blitt utviklet hvor det har blitt gjort endringer på måten man lager guide-RNA-tråden og selve Cas9-proteinet. Noen Crispr-varianter gjør det mulig å gjøre endringer i DNA-et uten å lage et dobbelttrådkutt i genomet (baseredigering og primærredigering). Du kan lese mer om disse metodene i denne GENialt-artikkelen. I tillegg har man utviklet Crispr-varianter som gjør det mulig å slå av og på gener ved å endre i cellenes epigenetikk (les mer om epigenetikk her).
Genredigering og etikk
Genredigering reiser nye etiske problemstillinger. Derfor pågår det også en viktig debatt om hvordan genredigering skal brukes og om hvordan genredigerte produkter skal reguleres. Mens noen etiske problemstillinger kan være relevant for genredigering i alle typer organismer, er andre etiske problemstillinger spesielt knyttet til genredigering i enten planter, dyr eller mennesker.
Genredigering i matproduksjon– en ny GM-debatt
Utviklingen av de klassiske genmodifiserte organismene (GMO) har i stor grad vært drevet av store, internasjonale selskaper blant annet fordi både utvikling og godkjenning er dyrt og tar lang tid. Markedet har vært, og er fortsatt i dag dominert av planter som har fått satt inn DNA fra andre arter for å bli resistente mot ugressmidler, skadeinsekter eller begge deler (se temaside om genmodifiserte planter og mat). Slike planter har blant annet blitt kritisert for å kunne bidra til økt bruk av plantevernmidler som de samme selskapene gjerne selger.
Genredigering med Crispr er en enklere, rimeligere og raskere metode. Dette gjør at genteknologien er tilgjengelig for flere og det forskes på og utvikles matplanter og dyr med andre egenskaper enn de tradisjonelle GMO-ene. Det kan være planter med forbedret næringsinnhold, bedre sykdomsresistens, mindre behov for kunstgjødsel (N2), tilpasning til lokale klimaforhold eller klimaendringer eller for eksempel steril oppdrettslaks som ikke kan parre seg med villaks om den rømmer fra merdene (hør mer om norsk Crispr-laks i Biotekpodden).
Med genredigeringsteknologien ser det ut til at den europeiske debatten omkring bruken av genteknologi nå i større grad enn før inkluderer muligheter ved egenskaper som kan endres, og ikke like mye om teknologien i seg selv er «bra» eller «dårlig».
Genredigering gir blant annet mulighet til å lage endringer i arvestoffet som tilsvarer dem som både kan og beviselig har oppstått naturlig, men på godt og vondt. Brukt riktig kan teknologien bli viktig for å møte globale utfordringer knyttet til mer bærekraftig matproduksjon. Dette har også ført til en diskusjon om hvorvidt dagens lovregulering av genredigerte organismer i Europa er hensiktsmessig. Et hovedspørsmål er om genredigerte organismer uten transgen fortsatt bør reguleres på samme måte som klassiske transgene GMO-ene, slik EU domstolen konkluderte i 2018. I de fleste land utenfor EU (unntatt New Zealand) er GMO-begrepet begrenset til organismer med «fremmed DNA» satt inn.
I 2020 ble det oppnevnt et offentlig utvalg i Norge, Genteknologiutvalget, som skulle drøfte fremtidens regulering av GMO-er. I juni 2023 la utvalget frem sin rapport, en NOU (Norges offentlige utredninger), med forslag til endringer i regelverket. En tilsvarende prosess, men foreløpig kun for planter, skjer samtidig i EU. I juli 2023 foreslo EU-kommisjonen et nytt regelverk for genredigerte planter uten fremmed DNA for EU-parlamentet. Forslaget går blant annet ut på at genredigerte planter uten fremmed DNA i hovedtrekk skal likestilles med planter fremstilt ved konvensjonell avl, og unntas GMO-regulering. Dette lovforslaget skal nå videre behandles i EU-parlamentet.
Usikkerhet ved genredigering
Når genredigering sammenlignes med tradisjonelle metoder for genmodifisering, fremheves det ofte at en med genredigering kan gjøre målrettede genetiske endringer i arvematerialet. Men all teknologi innebærer en viss grad av risiko for at noe går galt, får andre konsekvenser enn det som var hensikten eller brukes etisk feil. Dette gjelder også genredigering med Crispr. Mulige risikoer som diskuteres for genredigering er:
- off-target effekter: at det oppstår endringer andre steder i arvematerialet enn der man forsøkte å gjøre endringer.
- on-target effekter: at gensaksen klipper på riktig sted, men at reparasjonsmekanismene feiler slik at større DNA-segmenter går tapt eller stokkes om.
- mosaikk: at arvematerialet i noen celler har fått den riktige endringen, mens arvematerialet i andre celler ikke har fått endringen.
De praktiske og etiske konsekvensene av slike uønskede hendelser vil være forskjellige avhengig av om de skjer i en plante, om de skjer i et dyr eller menneske, og for mennesker om det skjer i kroppsceller (ikke-arvelige, genetiske endringer) eller i kjønnsceller som skal bli til et fremtidig barn (arvelige, genetiske endringer). Ved planteforedling vil man for eksempel genredigere en stor mengde planter, undersøke om en har fått til å gjøre endringene man ønsket, og så kaste alt som ikke var vellykket uten å ta større etiske hensyn til den enkelte plante. Om man derimot bruker genredigering i en befruktet eggcelle for å prøve å reparere en genfeil som gir sykdom, kan feil være katastrofale dersom egget implanteres og blir et barn. Slike feil i en kjønnscelle eller i et tidlig befruktet egg vil bli en del av alle det fremtidige barnets celler gjennom fosterutviklingen, også barnets egne kjønnsceller, og vil overføres til fremtidige generasjoner.
Arvelige genetiske endringer i mennesker – etisk utfordrende
I mennesker kan genredigering gjøres i kroppsceller (somatisk genredigering) eller i kimbanen (embryo, kjønnsceller og deres forløpere).

Ved somatisk genredigering vil kun bestemte celler i kroppen bli genredigert, og endringene vil ikke være arvelige. Dette er en form for genterapi og er allerede blitt tatt i bruk i mennesker. Du kan lese mer om somatisk genredigering på temasiden om genterapi.
Dersom de genetiske endringene blir gjort i kimbanen, vil de genetiske endringene forekomme i alle kroppens celler hos et fremtidig menneske. Dette betyr også at de genetiske endringene vil gå i arv i fremtidige generasjoner. Muligheten for å gjøre permanente endringer i arvelinjen er omstridt og stiller oss overfor flere og nye dilemmaer i spørsmålet om man skal tillate en slik bruk mennesker. Dette er det flere grunner til:
- Man behandler ikke et menneske som er født, men gjør endringer i arvematerialet til et fremtidig menneske.
- Det fremtidige barnet kan ikke gi sitt samtykke.
- Endringene er arvelige og vil bli videreført over flere generasjoner.
- Teknologien kan i prinsippet endre grunnleggende aspekter ved det å være menneske.
Lenge var det ikke teknisk mulig å gjennomføre genterapi på kjønnsceller og befruktede egg, fordi man ikke hadde gode metoder for å få nye gener inn i disse cellene. Men Crispr har gjort det mulig, og relativt enkelt, å endre på genene til mennesker både før og kort tid etter unnfangelsen. Likevel er det få forskere som har prøvd seg på dette både av tekniske, etiske, og juridiske årsaker.
Tvillingene i Kina
I 2018 kunngjorde forskeren He Jiankui at verdens første genredigerte babyer var født: Tvillingene Lulu og Nana som hadde fått sine genom endret for å gjøre dem mer motstandsdyktige mot HIV-infeksjon. Jankui ble møtt med massiv fordømmelse, både fra internasjonale forskningsmiljøer, publikum, og myndighetene i hans eget hjemland, Kina. Han ble arrestert og dømt både til fengselsstraff og til å betale en større bot for å ha drevet med ulovlig medisinsk behandling.
I kjølvannet av skandalen rundt Jiankui sendte en rekke kjente forskere et åpent brev til det vitenskapelige tidsskriftet Nature der de ba om et moratorium, et midlertidig selvpålagt forbud, mot å bruke genredigering til å skape arvelige genetiske endringer i kjønnsceller eller tidlige embryo. Blant forskerne var Emmanuelle Charpentier, en av forskerne bak Crispr-teknologien. Forskerne skrev at det er nødvendig å ta seg tid til en grundig diskusjon av tekniske, medisinske, samfunnsmessige og etiske spørsmål rundt arvelige endringer i mennesker før genredigering tas i bruk til dette.
Et forbud mot arvelige endringer i mennesker er også nedfelt i lovverk og retningslinjer for forskning i en rekke land og i internasjonale avtaler. I Norge er det lov å gjøre genetiske endringer i befruktede egg fra mennesker for å forske på dem, men slike befruktede må destrueres senest 14 dager etter befruktning og kan ikke settes inn i en kvinnes livmor.. Norge er også bundet av Biomedisinkonvensjonen, en internasjonal avtale som blant annet sier at det ikke er lov å gjøre genetiske endringer som vil gå i arv.
Mange tror likevel at det er et tidsspørsmål før genredigeringsteknologien er så god at å bruke genredigering for å gjøre arvelige genetiske endringer vil bli etisk akseptert og tillatt.
Spørsmål til diskusjon:
- Er det akseptabelt å endre dyrs gener ved hjelp av genteknologi? Om nei, hvorfor ikke? Om ja, i hvilke tilfeller og med hvilke formål?
- Norsk lov krever at organismer som kommer fra genmodifiserte organismer merkes som GMO i butikken. Bør det samme gjelde for organismer der man har redigert et gen til å bli lik en variant funnet i naturen? Hvorfor/hvorfor ikke?
- Er det noen forskjell på å bruke genteknologi til å endre gener i planter og i dyr?
- Hvorfor bør vi eller hvorfor bør vi ikke genredigere et befruktet egg for å unngå genfeil som kan føre til alvorlig sykdom hos et fremtidig barn?
Innholdet på denne siden ble sist oppdatert i oktober 2023. Send oss en e-post om du har kommentarer eller spørsmål til innholdet.
Referanser
- Jinek, M., et al., A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science, 2012. 337(6096): p. 816-21.
- Opinion on the Ethics of Genome Editing. 2021, European Commision
- Baylis, F., et al., Human Germline and Heritable Genome Editing: The Global Policy Landscape. The CRISPR Journal, 2020. 3(5): p. 365-377.