
Det første britiske barnet unnfanget etter mitokondriedonasjon kan bli født i år. Fagmiljøer i flere andre land varsler at de vil ta i bruk teknikken, som gjør at barn fødes med DNA fra tre personer.
Av Ruth Halsne, PhD i molekylærbiologi
I februar 2016 vedtok britiske politikere at de ville tillate mitokondriedonasjon ved prøverørsbefruktning, for å hindre overføring av sykdommer som skyldes defekte mitokondrier. Det finnes mange mitokondrier i hver celle og disse fungerer som små «kraftverk». Mitokondrier har sitt eget lille DNA, med 37 gener.
Mutasjoner i mitokondriegenene kan føre til defekt mitokondriefunksjon, som igjen kan gi alvorlige funksjonsnedsettelser og i mange tilfeller tidlig død hos barn. Siden mitokondriene inneholder sitt eget DNA, vil barn som fødes etter mitokondriedonasjon ha DNA fra tre personer – selv om donorens mitokondrie-DNA utgjør mindre enn 0,1 prosent av barnets arvestoff.
Les også: Når livets batterier svikter
Første barn født i 2016
De britiske politikerne stilte imidlertid krav om mer forskning før teknologien kunne tas i bruk av klinikkene. Mitokondriedonasjon er en eksperimentell og kontroversiell behandlingsform, og det gjøres fremdeles mye forskning for å finne den tryggeste behandlingsmetoden.
I november kom signaler fra britiske forskningsmiljøer om at de mente at metoden var klar for bruk på mennesker. Like før jul kom bekreftelsen fra Storbritannias Human Fertilisation and Embryology Authority (HFEA) om at klinikker kan søke om lisens til å utføre et begrenset antall forsøk med mitokondriedonasjon.
I mellomtiden har andre allerede tatt teknologien i bruk. I april i fjor ble en gutt født i Mexico etter mitokondriedonasjon. Hans jordanske mor er selv frisk, men er bærer av en andel syke mitokondrier som, dersom de nedarves, kan føre til Leigh syndrom – en alvorlig sykdom med forventet tidlig død. Også fra Ukraina er det rapportert to fødsler etter mitokondriedonasjon. Her ble metoden brukt for å hjelpe to tidligere infertile kvinner til å bli gravide.
Omstridt metode
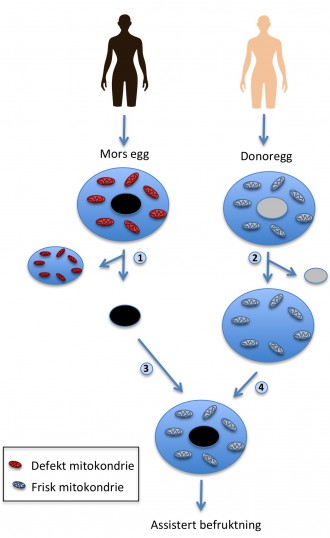
Samme dag som britiske HFEA åpnet for å dele ut lisenser, leverte Newcastle University, som kanskje er verdens fremste forskningssenter innen mitokondriedonasjon, sin søknad. I metoden som de har søkt om å bruke, lages to embryoer: ett med morens egg og ett med donorens egg. Begge blir befruktet, før cellekjernen fra donorembryoet erstattes av kjernen fra embryoet hvor morens egg er brukt. Det nye embryoet settes så inn i morens livmor.
Flere miljøer har tatt til orde for at denne metoden etisk sett er spesielt problematisk, siden to embryoer lages i prosessen, og det ene ødelegges underveis. En alternativ metode er at eggcellekjernen fra kvinnen som ønsker å bli mor settes inn i et kjerneløst donoregg fra en kvinne med friske mitokondrier, og at befruktningen skjer etterpå. Denne metoden er mindre etisk omstridt, men mer risikofylt, fordi det er vanskeligere å overføre kjernen i et ubefruktet egg uten at det følger med syke mitokondrier.
Man anslår at det første britiske barnet som blir født etter bruk av mitokondriedonasjon kan komme allerede i slutten av året eller første del av 2018.
Mange advarsler
Det mangler ikke på advarsler mot behandling med mitokondriedonasjon. Det finnes ingen metode for å unngå at en liten andel syke mitokondrier følger med cellekjernen når denne overføres til donoregget. Nyere forskning viser at det er mulig at barnet kan rammes av mitokondriesykdom i løpet av livet selv når 99 prosent av mors mitokondrier er fjernet, selv om sykdomsrisikoen er langt lavere når antallet syke mitokondrier er lavt. Studier har også vist at mors mitokondrier kan vokse raskere enn, og på sikt utkonkurrere, mitokondriene fra donor, og dermed føre til sykdom.
Siden det er mange mitokondrier i hver celle, kan man i flere tilfeller leve med en blanding av syke og friske mitokondrier uten selv å bli syk. Det er når graden av syke mitokondrier blir for stor, at man utvikler sykdom. Hvor mange syke versus friske mitokondrier man tåler, er avhengig av hvilke typer mutasjoner som forekommer. I tillegg til risikoen for overføring av syke mitokondrier, stilles det også spørsmål ved om barnet kan få sykdom eller funksjonsnedsettelser dersom de donerte mitokondriene fungerer dårlig sammen med kjerne-DNA-et fra moren. Slike risikoer må imidlertid veies opp mot risikoen ved å få et barn med kvinnens egne egg, dersom dette er et alternativ for paret.
De tidlige erfaringene med mitokondriedonasjon stammer fra dyreforsøk og tidlige humane embryo som kun får vokse noen få dager. Upubliserte data om gutten som ble født i Mexico viser at man i enkelte vev ikke har kunnet finne mitokondrier med mutasjon, mens det i andre vev er påvist nivåer opp mot ti prosent syke mitokondrier.
Les også: Genmodifiserte embryoer: Etisk omstridt forskningsfront
Ikke anbefalt av Bioteknologirådet
Bioteknologirådet i Norge kom i fjor med en anbefaling om ikke å åpne for mitokondriedonasjon på nåværende tidspunkt. Et stort flertall av rådets medlemmer mener teknologien kan være viktig, men at metoden samtidig reiser flere etiske problemstillinger.
Rådet pekte også på at mitokondriedonasjon vil kunne kategoriseres som genmodifisering, siden mitokondrier har sitt eget DNA. Det er bred internasjonal enighet om at man ikke skal gjøre genetiske endringer som kan gå i arv hos mennesker. Storbritannia har løst dette med å kun definere endringer i kjerne-DNA som genmodifisering, noe som har vært omstridt blant fagfolk. Bioteknologirådet uttalte at de vil følge med på erfaringene fra Storbritannia.



