Antallet personer som har fått sine gener sekvensert, øker kraftig. Men akkurat hvor mange, er det ingen som vet.
Av Truls Petersen, Ole Johan Borge og Elisabeth Gråbøl-Undersrud

I 2003, samme år som dagens bioteknologilov trådte i kraft, ble den første sekvensen av det humane genom publisert. Det USA-ledede arbeidet inkluderte forskere fra mange land, hadde tatt ti år, og kostet over ti milliarder kroner. I dag kan arvestoffet til et menneske bli sekvensert i løpet av et par dager til en kostnad under 10 000 kroner. Prisfallet har ført til mer sekvensering.
– Vi ser at veksten er nærmest eksponentiell, sier Ola Johnsborg, seniorrådgiver i Helsedirektoratet.
Helsedirektoratet mottar årlig tall fra de fem sykehusene som har godkjenning for å gjøre gentester. Johnsborg kan ikke svare på hvor mange som er sekvensert totalt i Norge fordi det bare finnes tall fra sykehusene. Sekvensering som gjøres i forskning, rapporteres ikke.
Årlig dobling fra 2012
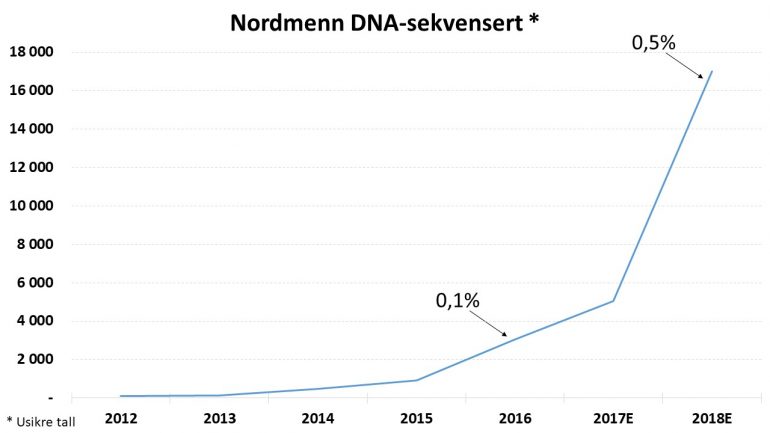
Med sekvensering kan du for eksempel finne ut om du er disponert for hjertelidelser eller om du har gener som gir økt risiko for kreft. Mange kan få medisin spesialtilpasset seg selv. Da sekvensering var i sin spede begynnelse på norske sykehus, ble 118 personer sekvensert (2012). Siden har det vært en dobling hvert år. Totalt ble 3531 personer sekvensert på norske sykehus fra 2012 og til 2016.
Gunnar Houge, seksjonsoverlege ved avdeling for medisinsk genetikk på Haukeland universitetssykehus, uttalte nylig på Bioteknologidagen at denne utviklingen vil fortsette.
Dermed kan vi vente at hele 7000 nordmenn vil bli sekvensert på norske sykehus i 2018. Fortsetter trenden like raskt de neste årene, vil over en halv million nordmenn være sekvensert i 2025. Da er vi nærme det framtidsscenariet som Torunn Fiskerstrand, overlege ved avdeling for medisinsk genetikk på Haukeland Universitetssykehus, beskrev i Aftenposten i 2014. Hun mente at det innen ti til femten år vil være standard prosedyre i norsk helsevesen at pasienter som kommer inn på sykehus, får alle genene sine undersøkt med genomsekvensering.
«Hvis trenden går like raskt de neste årene, vil over en
halv million nordmenn være sekvensert i 2025.»
Prisen går ned
Med sekvensering leser man av rekkefølgen på byggesteinene i arvestoffet, DNA. Sekvensering gjør det mulig å få detaljert informasjon om hele arvestoffet (genomsekvensering) eller alle genene (eksomsekvensering).
Tidligere gjorde man bare målrettede gentester for å se spesifikt på noen få aktuelle gener det var mistanke om er involvert i sykdom. I tillegg ble det særlig i forskningsprosjekter gjort såkalte SNP-analyser for å se etter en rekke ulike genvarianter, uten at arvestoffet ble sekvensert. SNP-analyser (single nucleotide polymorphisms) er variasjoner i enkeltbaser i DNA. Enkelte av disse variasjonene forårsaker sykdom. SNP-analyser brukes ofte ved utredning av barn og familier med sjeldne sykdommer.
I dag har eksom- og helgenomsekvensering i stor grad tatt over for SNP-analyser, og i stadig større grad også for de målrettede gentestene. Det er fordi det er enklere og billigere å sekvensere alle genene på en gang, enn å undersøke ett og ett gen om gangen.
Kartlegging av hele arvestoffet gir veldig mye informasjon. Derfor brukes ofte dataprogrammer for å se på kun de genene man vet kan være involvert i utvikling av en gitt sykdom. Dette gjør jobben mye enklere for dem som skal tolke resultatene, og reduserer muligheten for å oppdage noe helt annet enn det pasienten faktisk kom for å bli undersøkt for.
Fagfolk Bioteknologirådet har snakket med, gir uttrykk for at sekvensering fortsatt koster såpass mye at det begrenser bruken, men at prisen trolig vil fortsette å falle. Helsedirektoratet har pekt på at det ikke er sekvenseringen, men det å tolke dataene, som vil koste. I tillegg kommer økte personellkostnader fordi det tar tid å analysere dataene. Med den raske utviklingen innen programvarer vil prisen trolig gå ned.
Sekvensering i forskning
For å få et mer komplett bilde har Bioteknologirådet kontaktet forskningsmiljøer og spurt om de gjør sekvensering, og eventuelt hvor mange de har sekvensert.
Tallene vi har samlet inn er langt fra komplette. Så langt viser de at minst 4000 personer er genom- eller eksomsekvensert i ulike forskningsprosjekter. Det er særlig de store befolkningsundersøkelsene (som HUNT i Nord-Trøndelag og Mor-Barn-undersøkelsen i regi av Folkehelseinstituttet) som har tatt i bruk sekvensering.
Vi har også spurt forskerne hva de tror om bruken av sekvensering fremover, og alle forventer at bruken vil øke. Når vi legger sammen antall vi forventer blir sekvensert på norske sykehus med det forskerne har gjort og regner med å gjøre i løpet av 2018, så estimerer vi at omkring 31 000 personer vil være sekvensert ved utgangen av 2018. Det tilsvarer om lag 0,5 prosent av den norske befolkningen. Tallene fordeler seg omtrent jevnt på eksom og helgenomsekvensering, og mellom bruk på sykehus og i forskning.
Knut Ruyter er avdelingsdirektør for Regional komité for medisinsk og helsefaglig forskningsetikk (REK sør-øst), som er en av komitéene som vurderer etikken i forskningsprosjekter før forskerne kan sette i gang. Ruyter forteller at de stadig oftere får søknader på prosjekter hvor det er planlagt sekvensering.
Men også våre tall har huller. Blant annet finnes det en rekke mindre forskningsprosjekter som vi ikke har tall fra. I tillegg kommer de enkeltpersonene som selv har bestilt sekvensering fra ett av de utenlandske firmaene som tilbyr dette. Derfor kan vi med sikkerhet si at de reelle tallene er høyere enn vi har funnet ut så langt.
«Sekvensering har åpenbare fordeler for leger, forskere – og ikke minst pasienter»
Nytte og unytte
Sekvensering har åpenbare fordeler for leger, forskere – og ikke minst pasienter. Metoden gjør det mulig å undersøke en rekke gener uten å gjenta analysene flere ganger. Framgansmåten er derfor særlig nyttig der legen står uten noen klar idé om hva som feiler pasienten, eller for forskere som vil studere sammenhenger mellom mange gener.
Men teknologien skaper også utfordringer. Man kan gjøre funn man ikke er forberedt på, finne genvarianter vi ennå ikke kjenner funksjonen til, eller der sammenhengen med sykdomsrisiko er svak. I slike tilfeller er det ikke like opplagt hvordan resultatet fra sekvensering kan bli brukt for å velge videre behandling. Studier har vist at usikkerhet ofte genererer behov for flere undersøkelser. Dette er grunner til at blant annet Helsedirektoratet har pekt på at såkalt overdiagnostikk og overbehandling kan være utfordringer ved bruk av sekvensering. Det er også personvernutfordringer knyttet til å lagre store gensekvenser.