Genmodifiserte dyr blir brukte i blant anna forsking, medisin og matproduksjon. Hittil er genteknologi i hovudsak nytta til å lage forsøksdyr for biologisk og medisinsk forsking, men dei siste åra har fleire land også godkjent GM-dyr til havbruk og landbruk. Nye former for genmodifisering, såkalla genredigering, har gjort det enklare å endre på arvestoffet også i dyr. Framover vil vi derfor truleg sjå at det blir utvikla dyr med ulike typar endra eigenskapar.
Forsøksdyr som etterliknar menneskelege sjukdomar, kyr utan horn og grisar som ikkje blir sjuke av virussjukdommar, er nokre eksempel på genmodifiserte dyr. Laks som er steril, og som dermed ikkje kan formeire seg og påverke villfiskstammen om han rømmer frå oppdrettsanlegget, er eit anna eksempel. Kva har ei slik utvikling å seie for helsa og velferda til dyra? Og kva med omsynet til integriteten til dyra? Genmodifiserte dyr fører med seg heilt andre etiske problemstillingar enn genmodifiserte plantar og mikroorganismar.
Kva er ein GMO?
Det kjem an på kven du spør, og kva reglar som gjeld i den delen av verda dei bur. I den norske genteknologilova er GMO definert som «en organisme, unntatt mennesker, der genmaterialet er endret på en måte som ikke forekommer ved naturlig formering og/eller naturlig rekombinasjon». Det er den same definisjonen ein bruker i EU. Andre stader i verda er GMO-omgrepet avgrensa til organismar der ein har sett inn DNA frå andre artar, såkalla transgene dyr. Nye genteknologiske metodar (sjå temasida Genteknologi som endrer gener: fra genspleising til genredigering) gjer at det i dag er fleire organismar som er rekna som GMO i Europa, men ikkje andre stader i verda.
Omgrepet GMO omfattar ikkje organismar som har blitt til gjennom konvensjonell avl. Konvensjonelle avlsmetodar omfattar både det at vi menneske vel kva individ vi ønskjer skal få avkom (genetisk seleksjon), men òg teknologiar som for eksempel mutagenese og triploidisering. Mutagenese vil seie å bruke kjemikaliar eller strålebehandling for å lage ei stor mengde tilfeldige endringar (mutasjonar) i DNA. Metoden er mest kjend i samanheng med utvikling av nye plantar, men blir òg brukt på dyr, særleg laboratoriedyr. Ei anna metode – triploidisering – vart tidlegare brukt på oppdrettslaks der fiskeegg vart utsette for høgt trykk rett etter befruktning. Det førte til at fisken fekk ekstra kromosomsett, noko som gjorde oppdrettslaksen steril. Dette gjorde ein for å unngå at oppdrettslaksen skulle formeire seg med villaks om oppdrettslaksen skulle rømme.
Korleis lage eit genmodifisert dyr?
Når ein bruker genteknologi for å gjere genetiske endringar i dyr, ønskjer ein vanlegvis å lage dyr som har den genetiske endringa i alle celler, og som også kan føre vidare desse genetiske endringane til sitt avkom. Derfor gjer ein endringane anten i kjønnsceller eller kort tid etter at eit egg har blitt befrukta. Det er fleire måtar ein kan lage genmodifiserte dyr på, men dei har alle det til felles at ein må vite kva gen som kodar for den eigenskapen ein ønsker å endre i dyret. Nokre dyr, som mus, er mykje brukt i forsking og me har god kunnskap om kva gen som er knytt til forskjellige eigneskaper, mens for andre dyr har vi mindre oversikt. I tillegg er det stor skilnad på kor mange gen som er knytt til forskjellige eigneskaper. Til dømes er det at ein ku får horn eller ikkje knytt til eit enkelt gen. Det er difor rekna som ein kvalitativ eigenskap. Kor høg kua vil bli, avheng av ein rekke gen i samspel, og er eit døme på ein kvantitativ eigenskap. Det er i hovudsak dei kvalitative eigenskapane som eigner seg til genmodifisering.
Korleis ein lagar eit genmodifisert dyr er forskjelleg for ulike dyreartar. For dyr som legg egg, til dømes amfibium og fisk, treng ein ikkje ein surrogatmor. For pattedyr som til dømes sau, er det naudsynt med ein egna surrogatmor (sjå figur 1 nedanfor).
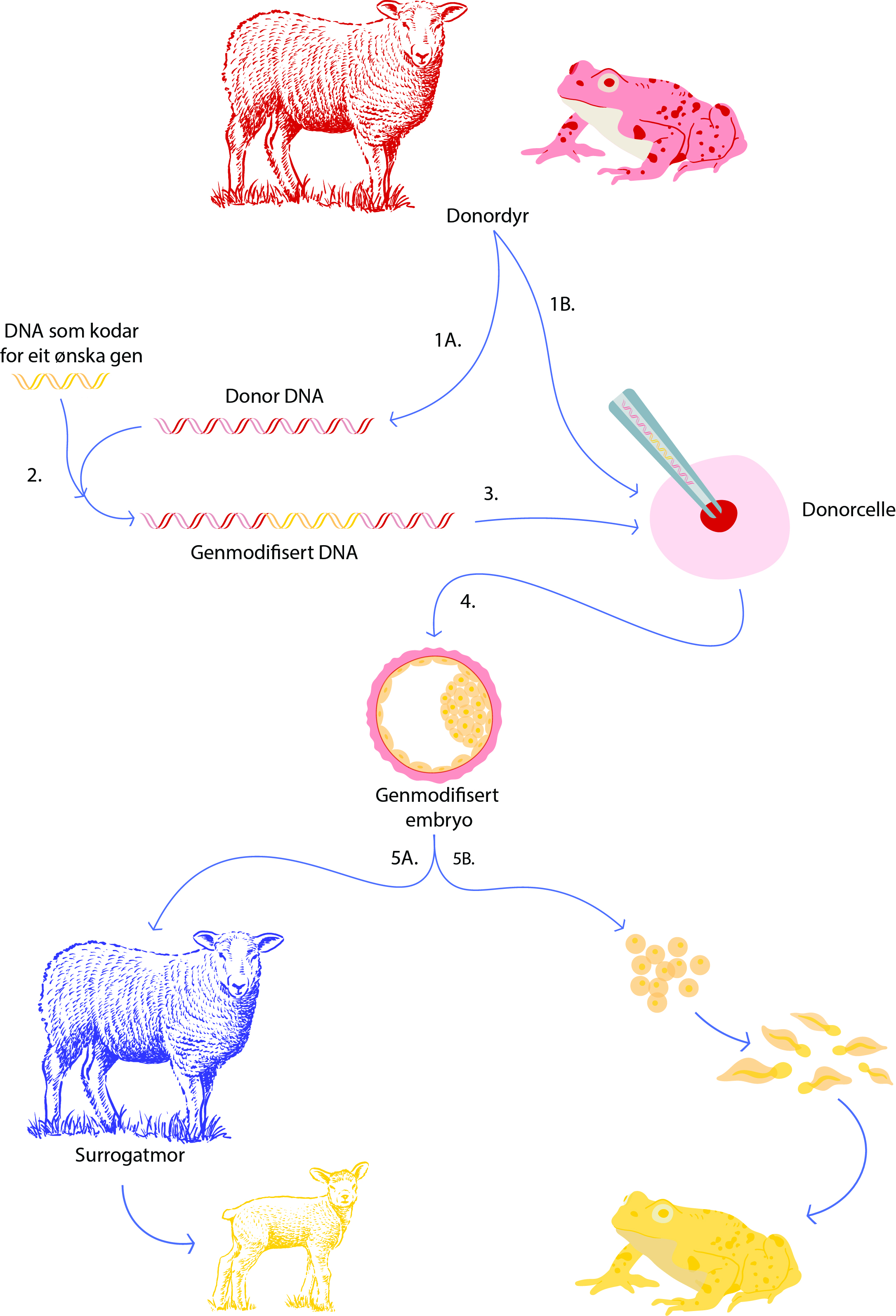
Når ein skal genmodifisere eit dyr startar ein med å isolere DNA (1A) og celler (1B) frå donordyr av arten ein ønsker å genmodifisere.
Deretter set ein inn eit stykke DNA (2) som koder for eit ønska gen.
Det genmodifiserte DNA-et set ein så inn i ein celle (3). DNA-et kan til dømes bli sett inn i ein sædcelle, ein embryonal stamcelle eller i ein cellekjerne som blir satt inn i eit kjernelaust egg.
Deretter blir det genmodifiserte embryoet (4) anten sett inn i livmora til ei surrogatmor (5A) om det er eit pattedyr, eller får utvikla seg vidare i laboratoriet om det er eit dyr som legg egg (5B).
Figur: Håvard Mallinson Eggestøl/Bioteknologirådet, basert på figurer av Marina Dekhnik, Sycomore og Pikovit44/iStock
Virusvektor: For å auke effektiviteten kan metoden for å lage genmodifiserte dyr kombinerast med bruk av ein virusvektor. Virus er naturleg gode på å transportere genetisk materiale inn i celler. Denne eigenskapen ved virus kan ein utnytte. Det genet som ein ønskjer å sette inn i cellene, blir då pakka i eit uskadeleggjort virus (ein såkalla virusvektor) som så hjelper genkonstruksjonen inn i cella.
Genredigering: Med nye genredigeringsmetodar som Crispr er det lettare å gjere endringar på ein ønskt stad i genomet enn før. Ved genredigering har ein fleire alternativ: Ein kan fjerne mindre eller større bitar DNA, gjere mindre endringar i ein genetisk sekvens, eller sette inn ein bit med DNA i eit dyrs genom. Gensaksa, og nokre gonger også ein gensekvens ein ønskjer sett inn, kan injiserast direkte inn i den befrukta eggcella kort tid etter befruktning, pakkast i ein virusvektor, eller ein kan gi eggcella ein kortvarig elektrisk støyt som forstyrrar cellemembranen (elektroporering), og lèt gensaksa sleppe inn i egget. Les meir om genredigering på temasida Genredigering og Crispr. Det er også mogleg å bruke genredigering i kroppsceller saman med kjerneoverføring (kloning) for å lage genredigerte dyr. Det er mellom anna nytta for å lage genmodifiserte dyr som skal likne utdøydde dyreartar som skrekkulven. Det kan du lese meir om i denne GENialt-artikkelen.
Genmodifiserte dyr som forskingsmodellar for menneske
Eit av dei viktigaste bruksområda for genmodifiserte dyr i forsking er å nytte dei som modellar for å forske på genetiske sjukdommar hos menneske. I slike dyr kan ein undersøkje korleis sjukdommar utviklar seg og prøve ut nye behandlingsformer. Dette gjeld mellom anna sjukdommar som ulike krefttypar, Huntingtons sjukdom og Alzheimers sjukdom. Under omtaler vi nokre eksempel.
Genmodifiserte mus blir mykje nytta i forsking for å finne ut kva funksjon eit gen har. Ein kan mellom anna sette inn eit gen for å finne ut korleis det bli slått av og på, eller korleis produktet som genet kodar for, verkar i spesielle celler. Ved å sette inn nytt DNA eller fjerne DNA kan ein òg endre eller øydeleggje eit gen, slik at ein eigenskap forsvinn heilt. Det er òg laga musemodellar der musene er genmodifiserte slik at dei lett får sjukdommar som finst hos menneske. Då kan forskarar mellom anna prøve ut nye behandlingar mot sjukdommen i dyra. Fysiologien og livsløpet til ei mus er likevel nokså annleis enn hos menneske, slik at musemodellar ikkje alltid vil gi god nok informasjon om alle typar menneskesjukdommar. Det blir derfor òg utvikla genetiske modellar for sjukdommar i andre dyreartar, som gris, rotte og hund.
Gris har fleire likskapstrekk med mennesket, som kroppsstorleik, anatomiske trekk og korleis organ og celler fungerer. Genmodifiserte grisar er derfor utvikla for sjukdommar hos menneske som hjarte- og karsjukdommar, ulike typar kreft, diabetes, cystisk fibrose og Duchennes muskeldystrofi.
Ved bruk av genredigering/CRISPR og kloning har kinesiske forskarar òg utvikla hundar som er disponerte for å få åreforkalking, ein sjukdom som rammar mange menneske over heile verda. Forskarane kan då teste ulike medikament for behandling.
Insekt blir òg nytta som forskingsmodellar for menneske. Bananfluga er eit lite insekt som lever på godt moden frukt. Arten er grundig forska på og er ein viktig modellorganisme for å forstå fenomen innan genetikk, embryoutvikling og forsking på kreft. Bananfluger er enkle å genmodifisere, halde i laboratoriet og krysse med kvarandre.
Genmodifiserte dyr innan medisin og helse
Genmodifiserte dyr har òg mange moglege bruksområde innan medisin. Transgene dyr kan blant anna brukast til å produsere medisinar for menneske. Ved å sette inn eit gen for eit ønskt protein i et dyr, kan dyret brukast som «proteinfabrikk». Det medisinske proteinet blir då uttrykt i dyret og kan reinsast ut frå mjølk, blod, urin, sæd eller egg. Til dømes er det utvikla kyr som produserer insulin i mjølka.
Antitrombin, eit protein som finst i blodet til menneske, og som hindrar blodet i å koagulere, var det første proteinet produsert i eit transgent dyr som vart godkjent for medisinsk bruk for menneske av europeiske legemiddelstyresmakter i 2006. Antitrombinet blir produsert av GM-geiter, og blir skilt ut frå geitemjølka og deretter nytta som eit medikament for å forhindre blodpropp hos pasientar som skal opererast, eller på pasientar som lir av arveleg antitrombinmangel. Les meir om geiter som produserer antitrombin i denne GENialt-saka. Legemiddelfirmaet som produserer antitrombin i geitemjølk, hevdar at éi genmodifisert geit i løpet av eitt år kan produsere like mykje antitrombin som ein tidlegare fekk ut av 90 000 bloddonasjonar.

Eit anna mogleg bruksområde for genmodifiserte dyr er som organkjelde for menneske. Det å bruke dyreorgan i menneskekroppen blir kalla xenotransplantasjon.
Grisar har organ som liknar våre i størrelse og funksjon, og det er derfor aktuelt å bruke organ frå gris i menneske. Men griseceller uttrykker nokre molekyl som ikkje finst på menneskeceller. Dette gjer at menneskekroppen raskt avslører eit griseorgan som noko framandt, og immunsystemet vil derfor gå til angrep og øydeleggje det transplanterte organet. Dette problemet jobbar forskarar med å løyse ved hjelp av genteknologi.
I januar 2022 fekk ein hjartesjuk amerikanar, 57 år gamle David Bennett, operert inn hjarte frå ein genmodifisert gris. Grisehjartet kom frå ein gris med ei rekkje genetiske endringar som vart gjorde for å hindre at pasienten sin kropp skulle avvise hjartet. Forskarane hadde både skrudd av fleire grisegen som kunne avsløre hjartet som framandt, og sett inn seks menneske-gen som er viktige for å kontrollere blodlevring, og for å dempe betennelsesresponsar. Operasjonen vart beskriven som vellykka, og legane fann ingen akutte teikn til at kroppen til David Bennett avviste hjartet. Bennett døydde diverre brått etter berre to månader med grisehjartet bankande i brystet. Fleire andre pasientar har også mottatt organ som nyre og lunge frå genmodifiserte grisar. Den først kliniske utprøvinga for transplantasjon av genredigerte grisnyre i menneske fekk godkjenning av dei amerikanske legemiddelmyndigheitene i FDA i 2025.
Du kan høyre meir om xenotransplantasjon og David Bennett i denne episoden av Biotekpodden:
Kinesiske forskarar fortalde i 2025 at dei har utvikla griseembryo med hjarteceller frå menneske, som utvikla seg fram til hjartet byrja å banke. Målet deira er å dyrke fram organ frå menneskecellar, inne i dyrekroppar, for å imøtegå den store mangelen på donororgan.
Genmodifiserte dyr i matproduksjon
Det er utvikla genmodifiserte dyr til bruk i matproduksjon med fleire ulike eigenskapar, og fleire er undervegs. Både konvensjonelle og nye former for genmodifisering, genredigering, har vore nytta i prosessen. Det er likevel ikkje mange slike dyr som er på marknaden i dag. Dyr som produserer medisinske stoff, har vore tilgjengelege ei stund, men det første genmodifiserte dyret som ble selt som mat var laks, som kom på marknaden i Canada i 2016. Sidan den gong har mellom anna genredigerte kulefisk komme for sal i Japan. I EU blir verken genmodifiserte dyr eller produkt av genmodifiserte dyr i dag selde til forbrukarar.
Landbruk
Gris, storfe og andre husdyr med endra gen er enda eit stykke unna middagstallerken dei fleste stadar i verda, men genredigeringsteknologi gjer at dette kan verta endra i åra som kjem. Storfe som har fått ein genvariant som gjer at dei får kort, glatt hår og toler varmt klima betre er tillaten å selja som menneskemat i USA og i Argentina. Genvarianten finst allereie hos storfe. Det betyr at desse kyrne ikkje treng spesiell godkjenning etter GMO-regelverket i dei to landa og derfor kan ha ein kortare veg ut på marknaden enn mange andre husdyr kor ein har satt inn gen frå ein annan art.
Forskarar har i løpet av dei siste åra også fått fram fleire typar genmodifiserte dyr som ikkje så lett blir sjuke. Her kan genteknologien bidra til både betre dyrevelferd og betre økonomi for bonden. Eit britisk avlsselskap søkte nyleg om godkjenning for gris som er genmodifisert for å vere motstandsdyktig mot Porcine Reproductive and Respiratory Syndrom (PRRS), ein alvorleg luftvegssjukdom hos gris. Selskapet har fått godkjenning mellom anna i USA, og håper at grisen vil verte tilgjengeleg som mat for forbrukarar om nokre år. Du kan lese meir om den virusresistente grisen i denne GENialt-artikkelen.
Fleire andre typar genmodifiserte produksjonsdyr er òg utvikla. Produksjonsdyr som veks fortare og produserer meir ull, kyr som har genvarianten som ikkje gir utvikling av horn (kolla kyr), eller kyr som lagar mjølk med lågare risiko for å utløysa allergi, er eksempel på dette.

I USA har forskarar også utvikla genmodifiserte mjølkekyr som har genvarianten som ikkje gir utvikling av horn (kolla kyr). Forskarane sette inn genvarianten som gir kolla dyr i arvestoffet til bindevevsceller av mjølkekyr. Cellene vart deretter klona, og dei klona kalvane som vart fødde, utvikla ikkje horn. Kyr med horn kan skade seg sjølve og andre kyr, i tillegg til dei som røktar kyrne. Ulike metodar blir i dag brukte på kalvar for å hindre at det veks ut horn, mellom anna avsviing eller varmluft. I Noreg er det pålagt å gi smertelindring ved slike inngrep. Det er òg mogleg å krysse inn genvarianten som gir kyr utan horn ved tradisjonell avl, om genvarianten er å finne i populasjonen frå før av. Ei genetisk fjerning av anlegg for horn sparer kyrne for det fysiske inngrepet etter fødselen. Samstundes kan fjerning av horn også vere ei ulempe for kyrne – horna er viktig for det sosiale spelet kyrne i mellom. For kyrne sjølv er det altså både fordelar og ulemper med å få horna fjerna, uavhengig av kva metode ein nyttar.
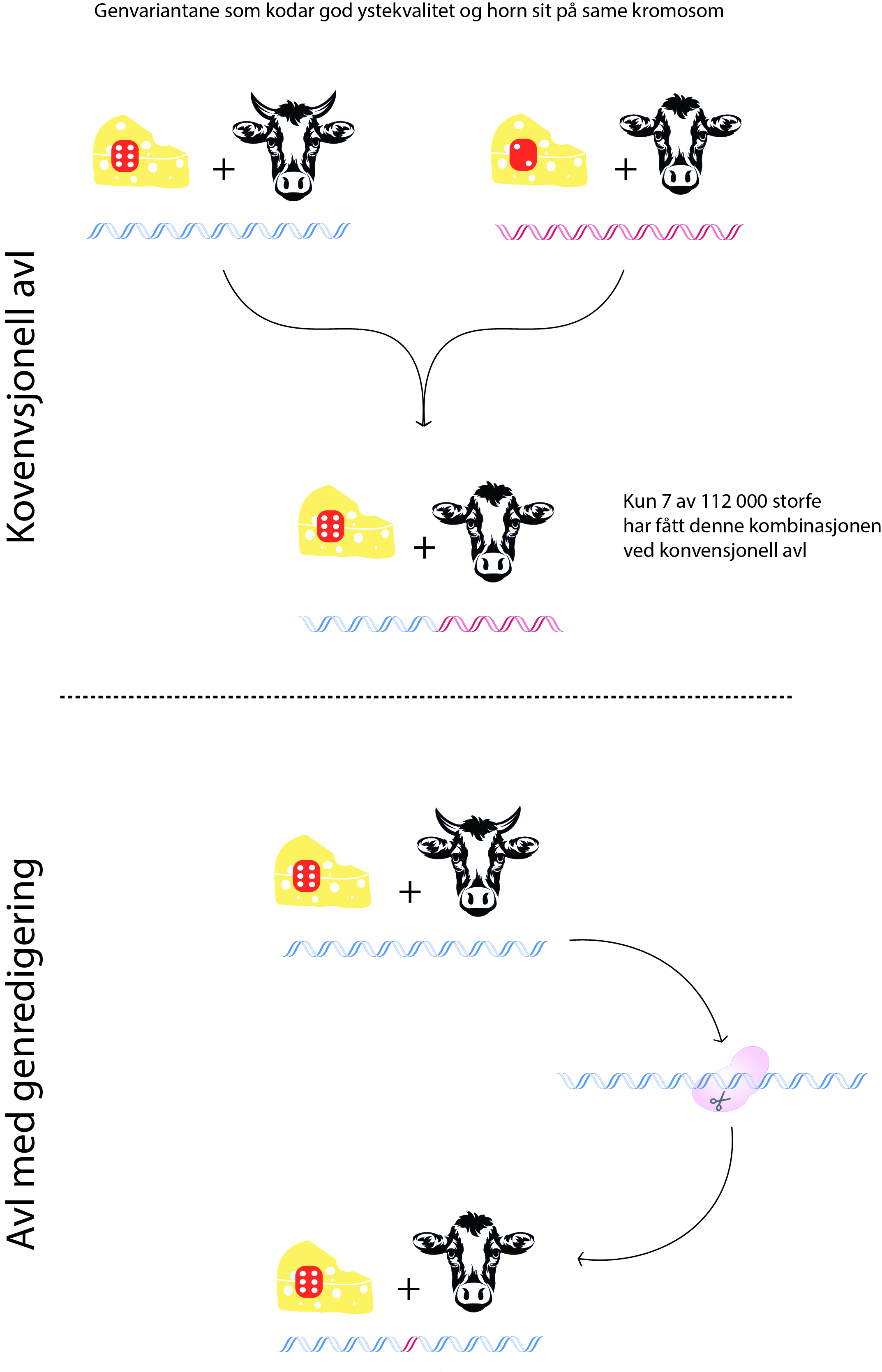
Norske mjølkebønder ønsker seg kyr som har mjølk med god ystekvalitet, men som ikkje har horn. Det er vanskeleg å få til med konvensjonell avl, då genvariantar som kodar for god ystekvalitet og genvarianten som kodar for horn sit på same kromosom. Ved konvensjonell avl har ein i dag berre klart å få frem 7 av 112 000 gentesta kyr som har denne kombinasjonen i storferasen Norsk rødt fe (NRF). Det er for få individ til at ein kan avla vidare på utan å få høg grad av innavl.
Eit alternativ til konvensjonell avl er å nytta genredigering, slik ein har gjort i fleire internasjonale forskingsprosjekt. Då beheld ein dei gode ysteeigenskapa, samstundes som ein unngår innavl.
Figur: Bioteknologirådet/Håvard Mallinson Eggestøl, basert på figurer av Sergey Lahtionov og Elena Yakovlieva /iStock

Havbruk
Fleirtalet av genmodifisert fisk meint for menneskemat er endå på forskingsstadiet, men nokre få slike dyr har fått marknadsføringsløyve i enkelte land. I 2016 vart ein genmodifisert laks godkjend for sal i Canada. I laksen Aquadvantage, som vart utvikla tidleg på 1990-talet, vart det sett inn DNA-bitar frå andre fiskeartar, slik at laksen skulle nå slaktevekt raskare og dermed skulle gi betre produktivitet enn laks som ikkje er genmodifisert. Denne laksen blir i dag produsert i lukka anlegg på land, og ikkje i opne merdar i sjøen. Også amerikanske godkjenningsstyresmakter (FDA) har godkjent Aquadvantage-laksen.
I Canada er det ikkje er særskilde krav til merking av den genmodifiserte laksen i butikken. Derfor veit heller ikkje kanadiske forbrukarar om laksen dei har på tallerkenen er genmodifisert eller ikkje. I USA må denne laksen, og produkt som stammar frå han, merkjast med «Bioengineered Food».
Japan har godkjent to Crispr-redigerte fiskar for sal: genredigert havkaruss og kulefisk (fugu). Begge desse fiskane har fått endra genomet sitt slik at fisken veks raskare. I havkarussen har ein oppnådd dette ved å forstyrre uttrykket av proteinet myostatin, eit protein som normalt fungerer som ein brems for muskelvekst. I den japanske kulefisken brukte forskarane i staden Crispr for å senke aktiviteten til genet for leptin-reseptor, ein reseptor som er viktig for å kontrollere appetitten til fisken. Denne fisken blir ikkje mett og et derfor mykje meir enn vanleg fisk og veks raskare. I begge tilfelle kan fiskeoppdrettarane produsere meir fisk på kortare tid, med lågare produksjonskostnader.

Det er gjort mange forsøk med genmodifisering av ulike fiskeartar. Forutan raskare vekst hos laks, havkaruss, kulefisk og tilapia (tropisk ferskvassfisk) er det óg laga fisk som skal tole kulde og sjukdommar betre. Fisk som toler kulde, kan alast opp på stader med kaldare vatn. Om fisken betre står imot sjukdom, gir det betre dyrevelferd. Ein kan òg bruke mindre ressursar på å hindre sjukdom i oppdrettsnæringa og minske faren for overføring av sjukdommar til villaks. Laks som er meir motstandsdyktig overfor alvorlege virussjukdommar og parasittar, som lakselus, er noko av det forskarane ønskjer å få til.
Genredigering har òg vore brukt for å få fram fisk med andre eigenskapar. I Bergen har forskarar ved Havforskingsinstituttet utvikla steril laks. Dette har dei fått til ved å bruke Crispr til å slå av eit gen nødvendig for at laksen utviklar kjønnsceller. Rømd oppdrettslaks som er steril, vil ikkje kunne formeire seg med villaks og vil dermed ikkje påverke villaks genetisk. I tillegg vil ein kunne unngå uønskt kjønnsmodning mens laksen veks i sjøen.
Annan bruk av genmodifiserte dyr
Den første genmodifiserte fisken som vart godkjend for sal, var ikkje meint for mat, men som akvariefisk. Desse fiskane har fått sett inn eit gen for fluorescerande protein frå andre havlevande organismar, som manet. Transgene fiskar som uttrykkjer fluorescerande protein, var for lengst tatt i bruk i forsking då eit taiwansk firma i akvariums-bransjen såg potensialet til å selje slike fiskar også som kjæledyr. I 2004 lanserte eit amerikansk firma sin eigen variant, ein sebrafisk, marknadsført under varemerket GloFish på den amerikanske marknaden. Sidan har det same firmaet laga akvariumsfisk med gen for fluorescerande protein henta frå andre havlevande organismar, og i dag finst det genmodifiserte sebrafisk i fleire spektakulære fargar for sal. Nokre av dei lysande akvariefiskane har kome seg ut i naturen, og du kan lese meir om GloFish på rømmen i denne GENialt-artikkelen.

Genredigert polohest
I Argentina har forskarar genredigert hestar, som er tiltenkt nytta i hestesporten polo. Føla er genetiske kopiar (klonar) av ei tidlegare premiehest, men forskarane har også gjort ein endring i eit gen som er involvert i muskeldanning med bruk av genredigering. Målet er at hestane skal bli større og sterkare enn premiehesten dei er avkommet til.
Genmodifisert mygg og gendrivarar

Forskarar har utvikla genmodifiserte insekt med tanke på å hindre sjukdom eller få bukt med skadedyr. Dette gjeld mellom anna genmodifiserte mygg av arten Aedes egypti, som er myggarten som spreier virussjukdommane denguefeber, gulfeber og zikafeber. Ulike typar genmodifisert mygg er laga, mellom anna mygg der avkommet døyr før dei sjølve rekk å formeire seg. Tanken er at genmodifisert hannmygg, som ikkje stikk og ikkje spreier smitte, skal settast ut i naturen i så store mengder at han kan konkurrere ut vill hannmygg. Les meir om debatten om den genmodifiserte Oxitec-myggen i denne GENialt-artikkelen.
Genredigeringsmetoden Crispr gjer det óg mogleg å få spreidd genetiske endringar til ein heil dyrebestand i løpet av få generasjonar. Det blir kalla gendrivarar. Du kan lese meir om gendrivarar på denne temasida.
Lovregulering
Internasjonalt blir det mykje diskutert korleis genredigerte dyr skal regulerast. Diskusjonen handlar om kva reglar som gjeld i dag, og kva reglar som er mest formålstenlege i framtida.
I Noreg er levande genmodifiserte organismar, inkludert dyr, regulerte i genteknologilova, mens produkt av genmodifiserte dyr til mat er regulerte i matlova.
Før levande genmodifiserte organismar eventuelt kan settast ut i naturen, gjer styresmaktene ei risikovurdering for å vurdere korleis helse- og miljøforhold kan bli påverka. Dette skjer etter felles europeiske reglar. Kva konsekvensar ein risikerer, og kor trulege desse er, blir då vurdert. I Noreg skal det i tillegg òg gjerast ei vurdering av kor samfunnsnyttig og etisk forsvarleg utsettinga er, og om ho medverkar til ei berekraftig utvikling. Denne vurderinga er det Bioteknologirådet som gjer. Krav om risikovurdering og godkjenning etter genteknologilova gjeld for omsetting og import av GMO-ar, inkludert genmodifiserte dyr. Det gjeld òg feltforsøk, der organismar skal settast ut som ledd i eit forskingsprosjekt, som for eksempel fisk i merdar eller insekt i naturen. Så langt har ingen GM-dyr fått godkjenning for utsetting eller som mat i EU eller i Noreg.
I tilfelle der genmodifiserte organismar blir haldne i lukka system, (såkalla inneslutta bruk) som laboratorium og dyrestallar med ekstra tryggingstiltak, er det andre føresegner som gjeld. Dersom det er risiko for utilsikta utslepp av GMO-ar, kan meir omfattande krav gjelde. Viss genmodifiserte organismar slepp ut i naturen ved eit uhell, kan det utgjere ein risiko for miljøet dersom dei etablerer seg og påverkar naturlege bestandar. Her vil det vere skilnad på kor stor påverknad ulike organismar vil ha på miljøet. Får dei mange avkom? Er det ville slektningar som dei kan formeire seg med? Er eigenskapen som dyret har fått ved genmodifisering, eit konkurransefortrinn i naturen, eller svekkjer det overlevinga til dyret? For eksempel kan det tenkjast at rømde kyr ikkje vil ha like stor påverknad på miljøet som rømde fisk, som får svært mange avkom i året og dermed spreier seg fort viss dei kjem ut i fjordar eller elver. Rømd oppdrettsfisk som ikkje er genmodifisert, vil òg kunne påverke villfisk negativt med tanke på helse og genetikk.
Velferd og eigenverdi for dyr
Ifølgje dyrevelferdslova har dyr eigenverdi uavhengig av nytteverdien dyra har for oss menneske. Dei skal òg behandlast godt og vernast mot unødige påkjenningar og belastningar, og dei har rett til å utfalde seg i tråd med den naturlege åtferda si. Dette er viktige moment i diskusjonar om etikken rundt genmodifisering av dyr. For genmodifiserte plantar og mikroorganismar vil det naturleg nok ikkje vere dei same etiske utfordringane som gjeld.
Ein kan hevde at genmodifisering av dyr for å tilpasse dei til moderne matproduksjon er i strid med respekten for dyret, fordi ein ønskjer å endre medfødde eigenskapar med genteknologiske metodar. Samtidig kan det vere relevant kva ein allereie gjer med dyra med andre metodar, og kva eigenskapar det er snakk om. Dersom målet for eksempel er å få dyret til å vekse fortast mogleg for å produsere mykje kjøtt på kort tid, må ein sjå på kva konsekvensar dette kan ha for helsa og velferda til dyret. Andre typar endra eigenskapar kan tenkjast å vere positivt for helsa og dermed dyrevelferda. Det gjeld mellom anna genredigerte grisar som er motstandsdyktige mot virussjukdommen PRRS , ein sjukdom som førar til liding og død for gris og grisungar verda over. Forbrukarar har i undersøkingar uttrykt at genmodifisering for å auke bondens profitt, for eksempel dyr som veks fortare, er mindre etisk akseptabelt enn genmodifisering som gir betre dyrevelferd. Det er likevel ikkje alltid så lett å skilje mellom desse to formåla, sidan betre helse og dyrevelferd òg ofte fører til høgare yting hos dyra og betra økonomi for bonden.
Spørsmål til diskusjon:
- Synest du det er ein viktig skilnad for ein GMO om eit dyr har fått sett inn eit gen frå ein annan art eller om den genetiske endringa er gjort i dyret sitt eige DNA?
- Synest du det er riktig å fjerne horna til mjølkekyr? Og kva er å føretrekke – å gjere det etter fødselen eller ved hjelp av genredigering?
- Synest du at det etisk sett er ein skilnad på å genmodifisere dyr for å førebyggje sjukdom, og dermed gi betre dyrehelse, og det å endre gena for å gjere at dyra produserer meir mjølk eller kjøtt? Kvifor/kvifor ikkje?
- Synest du at det etisk sett er ein skilnad på å genmodifisere produksjonsdyr samanlikna med dyr som blir brukte til medisinsk forsking for å studere sjukdommar hos menneske? Kvifor/kvifor ikkje?
- Fisk er òg omfatta av dyrevelferdslova. Er det etter di oppfatning nokon etiske skilnader på å genmodifisere fisk samanlikna med andre dyr som blir nytta til mat?
- Synast du det greitt å genredigere polohest slik at dei vert større og sterkare?
Innhaldet på denne sida vart sist oppdatert i desember 2025.
Send oss ein e-post om du har spørsmål eller kommentarar til innhaldet.