Genterapi er en form for medisinsk behandling der genetisk materiale (RNA eller DNA) overføres til menneskeceller for å behandle sykdom eller påvirke biologiske funksjoner. Nye genterapier kan gjøre det mulig å kurere sykdommer og lidelser det til nå har vært vanskelig å behandle, men muligheten til å gjøre genetiske endringer i mennesker byr også på mange etiske utfordringer.
Noen ganger skyldes sykdom feil i genene våre. Det kan være en medfødt genfeil (se temaside om arv og genetikk) eller feil som oppstår et sted i kroppen i løpet av livet. Genterapi er en form for medisinsk behandling der genetisk materiale overføres til kroppsceller, enten for å korrigere for en genfeil, for å endre effekten av en genfeil eller for å gjøre kroppens egne immunceller bedre på å bekjempe sykdom. I klassisk genterapi brukes ofte ufarliggjorte virus til å levere «nytt» genmateriale til celler. Ved genterapi med genredigering (for eksempel Crispr) repareres isteden genfeilen i genet ditt, der det er.
Det genetiske materialet, enten i form av DNA eller RNA, brukes for å reparere, erstatte, regulere, legge til eller fjerne deler av en gensekvens. Metodene brukt i genterapi, spesielt genredigering, kan også brukes til å endre kroppslige egenskaper som ikke er knyttet til sykdom. Da blir det viktig å ha klare regler for hva slags behandlinger som skal være tillatt, hvem som skal kunne få behandling, og hvem som skal kunne tilby dem.
Hva er genterapi?
Genterapi innebærer at DNA eller RNA tilføres cellene til en pasient, som oftest for å behandle sykdom. Med genterapi kan man gjøre ulike typer genetiske endringer:
- Hvis sykdommen skyldes en genfeil som gjør at det ikke produseres fungerende protein fra et bestemt gen, kan man tilføre cellene en kopi av det samme genet uten genfeilen, slik at det manglende proteinet blir produsert.
- I andre tilfeller kan sykdom skyldes at et gen er overaktivt og/eller har endret seg til å produserer et protein som er skadelig for kroppen. I slike tilfeller kan genterapi brukes til å hindre at cellene lager skadelige mengder av proteinet.
- Man kan også tilføre gener som gir cellene nye, sykdomsbekjempende egenskaper. Ett eksempel er å gjøre immunceller bedre på å gjenkjenne og drepe akkurat de kreftcellene pasienten har.
- Et gen med feil kan også slås ut eller repareres med genredigering (se temasiden om genredigering og Crispr).
Vaksiner basert på DNA eller RNA, som vaksinene fra Pfizer og Moderna mot COVID-19, inneholder også en liten bit med genetisk informasjon som skal hjelpe immunsystemet med å gjenkjenne og uskadeliggjøre virus. Men siden vaksiner ikke endrer dine gener (de tilfører virusgener) er vaksiner ikke definert som genterapi.
Hva brukes genterapi til?
Rundt om i verden forskes det på bruk av genterapi mot en rekke ulike sykdommer. Mange av studiene gjelder genterapi mot kreft, men det blir også nå utviklet terapier mot flere sjeldne arvelige sykdommer. Kreft skyldes også genfeil, men genfeil som tilfeldigvis skjer i noen celler slik at ukontrollert cellevekst starter (svulst).
Genterapi som aktiverer pasientens eget immunforsvar, har vist seg spesielt effektivt i behandling av noen typer kreft hos pasienter som ikke har hatt tilstrekkelig effekt av tradisjonell behandling som cellegift eller stråling. Ved det som kalles CAR-T genterapier henter man pasientens immunceller ut, tilfører genterapien som gjør at de blir bedre på å gjenkjenne og drepe de aktuelle kreftcellene, før de føres tilbake til pasienten (se figur 1). Slik genterapi kalles også immunterapi.
Det er også utviklet lovende behandlinger mot arvelige sykdommer (medfødt genfeil), blant annet ulike blodsykdommer, nevrologiske sykdommer, arvelig synstap og sykdommer som fører til alvorlig immunsvikt.
Hvordan gjøres genterapi?
For at genterapien skal virke som den skal, må det terapeutiske genet først nå frem til riktig vev/organ. Det finnes to hovedstrategier for å oppnå dette: cellene behandles utenfor kroppen som ved CAR-T (ex vivo) eller cellene behandles der de er og skal fungere, inne i pasienten (in vivo) (se figur 1).
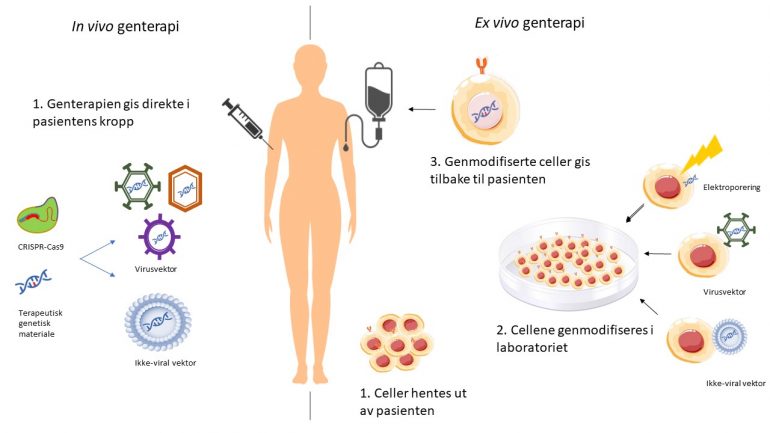
Ved klassiske genterapier må det terapeutiske, genetiske materialet også transporteres inn i cellene på en effektiv måte (figur 1). DNA er store molekyler som ikke kan krysse cellemembranen og komme inn i cellen på egen hånd. For at genmaterialet skal komme inn i cellene, må en derfor bruke en såkalt vektor, eller bærer, som kan beskytte det terapeutiske materialet. Det terapeutiske materialet kan pakkes inn i et uskadeliggjort virus, en ikke-viral vektor (for eksempel en liten fettpartikkel, et liposom), eller cellene kan gis et lite støt for å ta opp nakent DNA (elektroporering).
Ulike virusvektorer har ulike egenskaper. Noen setter inn genmaterialet i cellens eget DNA permanent (integreres). Da er de genetiske endringene permanente i de modifiserte cellene og i deres datterceller. Ved bruk av andre typer vektorer kan det genetiske materialet bli værende utenfor cellekjernen. Da er endringene midlertidige, siden DNA-et/RNA-et forsvinner over tid etter hvert som cellene deler seg.
Genterapi – historien bak
Den første godkjente utprøvingen av genterapi fant sted i 1990. Da fikk fire år gamle Ashanti DeSilva, som den første i verden, behandling med genterapi for en arvelig genetisk sykdom, ADA-SCID, en lidelse som dramatisk svekker immunforsvaret. Dette forsøket åpnet for flere genterapeutiske utprøvinger på pasienter med ulike arvelige sykdommer de påfølgende årene. Dessverre hadde flere av de tidlige genterapibehandlingene dårlig effekt, og noen av pasientene utviklet alvorlige bivirkninger. Flere pasienter som deltok i disse tidlige forsøkene, fikk kreft eller alvorlige immunreaksjoner mot virusvektor. Dette førte til at utviklingen på feltet stoppet nesten helt opp i flere år. Noen forskere valgte imidlertid å jobbe videre med å utvikle bedre terapier og sikrere metoder for å levere genterapi inn i cellene. Flere genterapier har nå lav nok risiko for alvorlige bivirkninger og så godt dokumentert effekt at de har kommet gjennom nåløyet hos godkjenningsmyndighetene i USA, EU eller andre deler av verden.
Genterapi på vei inn i helsevesenet
Høsten 2018 ble det vedtatt at genterapi for første gang skulle tilbys norske pasienter gjennom den offentlige helsetjenesten. Denne genterapien er en CAR-T terapi som i Norge brukes for å behandle akutt lymfoblastisk leukemi hos barn. Senere er flere genterapier blitt tilgjengelig for norske pasienter.
Det er også nye genterapier under utprøving for en rekke ulike sykdommer, og genterapi forventes å få stor betydning for medisinsk behandling fremover. Dessverre er genterapibehandlinger ofte svært kostbare, og så nye at langtidseffekten av behandling er ukjent. Dette utfordrer de etablerte prinsippene som ligger til grunn for å vurdere hvilke legemidler som skal få offentlig finansiering og dermed kan tas i bruk i helsevesenet (Les mer om Genterapi og prioritering in GENialt #4 2021).
Genterapi 2.0 – genredigering
Et nytt genteknologisk verktøy, genredigering, gjør det nå mulig å gjøre enda mer presise genetiske endringer i humane celler(se temasiden om genredigering og Crispr). Genredigering spås å bli den foretrukne metoden for genterapi i fremtiden. Der man ved tradisjonell genterapi kun kan gjøre én type modifikasjon – å sette inn nytt genetisk materiale i cellene, kan man ved genredigering gjøre flere typer endringer. Man kan for eksempel fjerne eller «skru av» en genvariant som gir sykdom, gjøre mindre endringer i gensekvensen for å reparere et skadet gen, eller sette inn nytt genetisk materiale.
I desember 2020 kom de første resultatene fra en studie der genredigering er brukt ex vivo for å behandle sigdcelleanemi og beta-talassemi hos mennesker. Forskerne skrudde på et gen for hemoglobin som vanligvis bare er aktivt i fosterlivet, for å erstatte funksjonen til genet for «vanlig» hemoglobin der disse pasientene har en genfeil. Behandlingen for sigdcelleanemi ble godkjent i Storbritannia (november 2023) og USA (desember 2023) – som verdens første godkjente Crispr-terapi.
I august 2021 kom resultatene av den første studien der genredigering ble brukt direkte i pasienter, in vivo. Her ble genredigering brukt for å behandle en livstruende sykdom som skyldes en genfeil som fører til at feildannet protein, transtyretin, opphoper seg i nerver og hjertevev. Les mer om denne studien her. Terapeutisk genredigering for en rekke andre ulike tilstander er også under utprøving. Resultatene av slike utprøvinger vil vise om disse nye terapiene er trygge og effektive nok til å bli en del av behandlingstilbudet til pasienter i fremtiden.
Februar 2025 markerte en ny milepæl for Crispr-teknologien, da forskere ved Children’s Hospital of Philadelphia og Penn Medicine utviklet en ny, Crispr-basert, persontilpasset behandling for en arvelig sykdom. Du kan lese mer om dette på temasiden for persontilpasset medisin.
Etiske utfordringer
Med ny teknologi som gjør det mulig å endre på menneskers gener, oppstår også en rekke etiske utfordringer. Kostbare behandlinger kan bidra til å øke sosiale forskjeller, og mange er bekymret for at muligheten til å endre genene våre vil gi mindre rom for mangfold og individuell variasjon. Ved bruk av genredigering, som gjør det mulig å lage målrettede endringer i cellenes arvestoff, både i kroppsceller og i kjønnsceller og befruktede egg, står vi overfor spesielle etiske utfordringer. Særlig etiske utfordringer er knyttet til det å gjøre genetiske endringer i kjønnsceller og befruktede egg, fordi disse endringen ikke bare vil påvirke individet som får genterapien, men også kan gå i arv til personens etterkommere. Konsekvensene av genterapi avhenger av hvilke celler man velger å behandle.
- Somatisk genterapi: Ved genterapi i kroppsceller (somatiske celler) skjer den genetiske endringen kun i pasientens kroppsceller og vil ikke gå i arv. Dersom det tilførte genetiske materialet blir liggende utenfor cellekjernen brytes det ned over tid, og endringene er midlertidige. Dersom tilført DNA integreres i cellens eget kjerne-DNA vil endringene være permanente og tilstede i cellene som er behandlet resten av cellenes levetid.
- Genterapi i kjønnsceller/befruktede egg: Dersom genterapien gjøres på egg-, sædceller eller på et befruktet egg som settes inn i livmor og får utvikle seg til et barn, vil de genetiske endringene bli en del av alle det nye individets celler, inkludert kjønnscellene. Da kan de genetiske endringene også overføres til kommende generasjoner.
Genterapi som gir arvelige genetiske endringer kan ikke bare forhindre at et barn fødes med en alvorlig arvelig sykdom, men kan i prinsippet utrydde sykdommen ved at genvarianten som fører til sykdom ikke lengre nedarves. Dette stiller oss overfor store etiske dilemmaer i spørsmålet om man skal tillate slik behandling i mennesker.
Arvelige endringer – en vitenskapelig og etisk debatt
Debatten om hvorvidt vi bør tillate å endre gener slik at endringene går i arv til våre etterkommere dreier seg i hovedsak om nytte, risiko , usikkerhet og etikk.
Bruk av legemidler og annen medisinsk behandling innebærer alltid en grad av risiko for at noe går galt eller for uønskede bieffekter. For genredigering inkluderer dette for eksempel eventuell risiko for utilsiktede endringer (les mer om tekniske utfordringer på vår temaside om genredigering). Dersom genredigering benyttes på kjønnsceller eller befruktede eggceller for å reparere genfeil som kan gi sykdom, kan upresis redigering få alvorlige konsekvenser. Ikke bare er det risiko for at genfeilen ikke blir reparert, slik at barnet likevel blir sykt, men man risikerer kanskje også å lage helt nye feil i genomet.
Det er også usikkerhet rundt hvilke biologiske, helsemessige, og sosiale følger arvelige genetiske endringer kan ha på sikt. Vi vet for eksempel fremdeles lite om hvordan ulike gener påvirker hverandre. Kanskje genet vi har endret på eller fjernet var viktig for en annen biologisk prosess eller ville gi fordeler under andre betingelser enn de vi lever under i dag?
I 2018 ble det kjent at verdens første genredigerte babyer var født: Tvillingjentene Lulu og Nana. Forskeren He Jiankui hadde brukt Crispr til å klippe i genet CCR5, som HIV bruker som en inngangsport til å infisere cellene. Jankuis kunngjøring ble møtt med fordømmelse, og han ble kritisert for å ha utsatt jentene for unødig risiko. Tvillingenes far var HIV-positiv, men det finnes andre, effektive, og mindre risikable metoder for å forhindre at en HIV-positiv far smitter fremtidige barn. Mange var bekymret for at genredigeringen kan ha gitt utilsiktede endringer i tvillingenes genom, og kritiske stemmer påpekte at vi ikke kjenner alle funksjonene til proteinet CCR5-genet koder for.

I etterkant av offentliggjøringen har ulike studier knyttet genvarianter som ligner endringene som er gjort i tvillingene, til alt fra forbedret hukommelse og hjernefunksjon, til redusert motstandsdyktighet mot influensa og andre virusinfeksjoner, samt redusert forventet levealder. Dette har ført til spekulative overskrifter som: «Kinas CRISPR-tvillinger kan ha fått hjernen utilsiktet forbedret.» eller «Verdens første genredigerte babyer mer sannsynlig til å dø unge». Ingen av studiene kan imidlertid svare på hvilke konsekvenser (om noen) de genetiske endringene vil ha for Lulu og Nana på sikt.
I kjølvannet av skandalen rundt den kinesiske forskeren, sendte en rekke kjente forskere i 2019 et åpent brev til det vitenskapelige tidsskriftet Nature der de ba om et moratorium, et midlertidig selvpålagt forbud, mot å bruke genredigering til å skape arvelige genetiske endringer i mennesker. De skrev at det er nødvendig å avklare både tekniske og etiske spørsmål rundt arvelig genredigering i mennesker før metoden tas i bruk.
I dag er det stor enighet om at tiden enda ikke er moden for å gjøre arvelige endringer i mennesker, og internasjonale avtaler som biomedisinkonvensjonen har skriftlig forbud. Mulighetene genredigering nå gir for å kunne «utrydde genetiske sykdommer» gjør imidlertid at det igjen pågår en internasjonal debatt rundt dette. En vanlig etisk innvending mot å lage arvelige genetiske endringer i mennesker er at det er svært inngripende å endre på et menneskes gener, og at det vil være galt å endre på fremtidige menneskers grunnleggende genetiske forutsetninger, uten at de har mulighet til å samtykke. En slik inngripen vil være i strid med menneskers rett til en åpen framtid. På den annen side vil noen mene at det er uetisk å ikke forhindre, og kanskje utrydde, alvorlig, genetisk sykdom dersom vi har muligheten til det.
Behandling, forebygging, forbedring
Genredigering kan i teorien brukes til å endre på alle menneskets gener, ikke bare de genene som er knyttet til sykdom. Genredigering brukt i menneskelige kjønnsceller eller befruktede egg kan også brukes til å «forbedre» andre egenskaper hos et fremtidig barn.
Også somatisk genredigering kan brukes til å forbedre egenskaper som ikke har noe med sykdom å gjøre. Idrettsutøvere kan for eksempel ønske å bruke genredigering til å øke blodsirkulasjon, muskelvekst eller smertetoleranse for å forbedre sine prestasjoner. Dersom genterapi blir brukt av idrettsutøvere for å forbedre idrettsprestasjoner kalles det gendoping. Selv om det enda ikke finnes dokumentasjon på at idrettsutøvere har tatt i bruk gendoping, er dette en problemstilling idrettsverden er bekymret for at vil dukke opp i fremtiden. Verdens anti-dopingbyrå (WADA) har både nedsatt en egen ekspertgruppe og innført egne regler for å hindre gendoping. Det er også utviklet tester for å lete etter tegn til gendoping i blod fra utøvere.
Spørsmål til diskusjon:
- Er det å erstatte eller korrigere genfeil med genterapi på fødte individer prinsipielt mer problematisk enn annen medisinsk behandling?
- Er det noen forskjell på å bruke genterapi/genredigering for å behandle en arvelig sykdom i et eksisterende individ i forhold til bruk på befruktet egg slik at et fremtidig barn ikke får slik sykdom?
- Er det forsvarlig å ikke genredigere et embryo dersom dette kan hindre alvorlig sykdom hos et fremtidig barn?
- Bør det være forbudt å bruke genredigering for å endre på egenskaper som ikke har noe med sykdom å gjøre?
Innholdet på denne siden ble sist oppdatert i september 2025. Send oss en e-post om du har kommentarer eller spørsmål til innholdet.
Referanser:
- van Haasteren, J., et al., The delivery challenge: fulfilling the promise of therapeutic genome editing. Nature Biotechnology, 2020. 38(7): p. 845-855.
- Frangoul, H., et al., CRISPR-Cas9 Gene Editing for Sickle Cell Disease and β-Thalassemia. New England Journal of Medicine, 2020. 384(3): p. 252-260.
- Gillmore, J.D., et al., CRISPR-Cas9 In Vivo Gene Editing for Transthyretin Amyloidosis. New England Journal of Medicine, 2021. 385(6): p. 493-502.
- Cohen, J., Did CRISPR help—or harm—the first-ever gene-edited babies?, in Science News. 2019, AAAS: doi: 10.1126/science.aay9569.
- Tozaki, T. and N.A. Hamilton, Control of gene doping in human and horse sports. Gene Therapy, 2021.
- Bioteknologiloven, Lov om humanmedisinsk bruk av bioteknologi m.m. 2003.




